Tripolifosfato de sodio (Na5P3O10): estructura, propiedades, usos, impacto
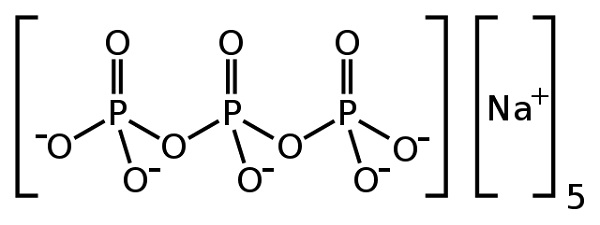
El tripolifosfato de sodio es un compuesto inorgánico formado por cinco iones sodio Na+ y un ión tripolifosfato P3O105-. Su fórmula química es Na5P3O10. El ion tripolifosfato contiene tres unidades de fosfato unidas entre sí y es lo que se llama un fosfato condensado.
El anión tripolifosfato P3O105- tiene la capacidad de atrapar iones como el de calcio Ca2+ y el de magnesio Mg2+, por lo cual el tripolifosfato de sodio es utilizado como ayuda en detergentes para que estos funcionen mejor en cierto tipo de agua.
El tripolifosfato de sodio también se emplea como fuente de fósforo en la alimentación de animales de pastoreo y en el tratamiento de algunas dolencias de otros tipos de animales. Sirve también para espesar y dar textura a algunos alimentos procesados como cremas, pudines y quesos.
En la industria agrícola se emplea en fertilizantes en gránulos para evitar que estos se peguen entre sí y puedan permanecer sueltos.
Aunque ha habido discusiones acerca del impacto ambiental del tripolifosfato de sodio que se añade a los detergentes, actualmente se estima que no contribuye apreciablemente a dañar el ambiente, al menos a través de los detergentes.
Índice del artículo
- 1 Estructura química
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos
- 6 Impacto ambiental
- 7 Riesgos
- 8 Referencias
El tripolifosfato de sodio forma parte de los denominados fosfatos condensados porque se trata de varias unidades de fosfato unidas entre sí. En este caso el ion tripolifosfato es un fosfato condensado lineal pues posee una estructura lineal tipo cadena, con enlaces fósforo-oxígeno-fósforo (P–O–P).
– Tripolifosfato de sodio
– Trifosfato de sodio
– Trifosfato de pentasodio
– STPP (siglas del inglés Sodium TriPolyPhosphate)
Sólido incoloro a blanco cristalino.
367,86 g/mol.
622 °C.
2,52 g/cm3
Soluble en agua: 20 g/100 mL a 25 °C y 86,5 g/100 mL a 100 °C.
Una solución al 1% de tripolifosfato de sodio posee un pH de 9,7-9,8.
Es un agente secuestrador de iones, esto es, puede atrapar iones y mantenerse unido a ellos. Forma complejos con muchos metales.
Si se calienta una solución de tripolifosfato de sodio durante un tiempo prolongado este tiende a convertirse en ortofosfato de sodio Na3PO4.
Es ligeramente higroscópico. Forma hidratos estables, es decir, compuestos que tienen unidas moléculas de agua (sin haber reaccionado con esta) de fórmula Na5P3O10.nH2O donde n puede valer entre 1 y 6.
Según algunas fuentes, una cantidad de 20 mg de tripolifosfato de sodio en un litro de agua no afecta el olor, sabor o pH de dicha agua.
El tripolifosfato de sodio se prepara deshidratando ortofosfatos (como por ejemplo fosfato monosódico NaH2PO4 y fosfato disódico Na2HPO4) a temperaturas muy altas (300-1200 °C):
NaH2PO4 + 2 Na2HPO4 → Na5P3O10 + 2 H2O
También se puede obtener por calcinación controlada (significa calentamiento a muy alta temperatura) de ortofosfato de sodio Na3PO4 con carbonato de sodio Na2CO3 y ácido fosfórico H3PO4.
El tripolifosfato de sodio tiene la propiedad de formar compuestos con ciertos iones, reteniéndolos. Además tiene propiedades dispersantes de las partículas de sucio y las mantiene en suspensión.
Por esta razón, es muy utilizado en formulaciones de detergentes para atrapar e inmovilizar iones calcio Ca2+ y magnesio Mg2+ del agua (de las denominadas aguas duras) y para mantener suspendido el sucio en el agua.
Los iones mencionados interfieren en la acción de limpieza. Al atraparlos el tripolifosfato evita que dichos iones precipiten junto con el agente limpiador o se peguen del sucio en la tela impidiendo que la mancha se despegue de esta.
Se dice en este caso que el tripolifosfato de sodio “suaviza” el agua. Por esto, se usa en detergentes para ropa y en detergentes para lavaplatos automáticos.
Dado que forma hidratos estables, los detergentes que lo poseen en su formulación pueden ser secados de forma instantánea mediante pulverización (rocío muy fino) formando polvos secos.

El tripolifosfato de sodio se utiliza como suplemento en soluciones líquidas como fuente de fósforo para el ganado.

También sirve para prevenir los cálculos renales en gatos, para lo cual se suministra de forma oral a dichos animales. Sin embargo, debe ponerse atención en la dosis ya que puede causar diarrea.

Se ha empleado el tripolifosfato de sodio en la preparación de nanopartículas para el transporte y liberación adecuada de fármacos de quimioterapia contra el cáncer. También se ha utilizado en nanopartículas para el tratamiento de infecciones de hongos en los pulmones.
Se usa en productos lácteos como por ejemplo pudines, crema batida, crema agria y queso.

En otros alimentos se emplea como secuestrador de iones, para dar textura, como espesante y como conservante.
– Como estabilizador de peróxidos
– En fluidos de perforación de pozos de petróleo funciona como emulsionante y dispersante para controlar la viscosidad del lodo.
– En agricultura se emplea como agente antiapelmazante de ciertos fertilizantes o productos agrícolas, esto significa que evita que se adhieran entre sí y el fertilizante pueda ser distribuido con facilidad. También se usa en fórmulas de pesticidas aplicados a cultivos en crecimiento.

El uso de productos con fosfatos ha sido identificado como uno de los contribuyentes de la eutroficación de las aguas en el planeta.
La eutroficación es el crecimiento exagerado y de forma acelerada de algas y especies vegetales acuáticas que conducen a una fuerte disminución del oxígeno disponible en el agua, llevando a la destrucción al ecosistema afectado (muerte de la mayoría de las especies animales en este).

En la década de los años 1980 surgió la controversia acerca de que la utilización del tripolifosfato de sodio en los detergentes estaba contribuyendo a la eutroficación.
Hoy en día se sabe que limitar el uso de detergentes con tripolifosfato de sodio contribuiría muy poco a eliminar la eutroficación, ya que los fosfatos provienen en mayor cantidad de otras fuentes agrícolas e industriales.
De hecho hay países que consideran al tripolifosfato de sodio como un componente ambientalmente amigable de los detergentes y promueven su utilización.
El tripolifosfato de sodio es irritante de la piel y de los ojos. El contacto con los ojos puede causar daño a estos. Un contacto prolongado con la piel puede producir dermatitis.
Si se ingiere en grandes cantidades puede causar nausea, vómitos y diarrea, generando también reducción seria del ion calcio en la sangre. En animales ha causado disminución del calcio en los huesos.
Se considera un compuesto seguro siempre que se sigan las normas de manufactura del producto en el cual se emplea.
- Liu, Y. and Chen, J. (2014). Phosphorus Cycle. Reference Module in Earth Systems and Environmental Sciences. Encyclopedia of Ecology (Second Edition). Vol. 4, 2014, pp.181-191. Recuperado de sciencedirect.com
- U.S. National Library of Medicine. (2019). Sodium tripolyphosphate. National Center for Biotechnology Information. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Mukherjee, B. et al. (2017). Pulmonary Administration of Biodegradable Drug Nanocarriers for More Efficacious Treatment of Fungal Infections in Lungs: Insights Based on Recent Findings. In Multifunctional Systems for Combined Delivery, Biosensing and Diagnostics. Recuperado de sciencedirect.com.
- Kirk-Othmer. (1991). Encyclopedia of Chemical Technology. 4th New York, John Wiley and Sons.
- Burckett St. Laurent, J. et al. (2007). Laundry Cleaning of Textiles. In Handbook for Cleaning/Decontamination of Surfaces. Recuperado de sciencedirect.com.
- Budavari, S. (Editor). (1996). The Merck Index. NJ: Merck and Co., Inc.
- Salahuddin, N. and Galal, A. (2017). Improving chemotherapy drug delivery by nanoprecision tools. In Nanostructures for Cancer Therapy. Recuperado de sciencedirect.com.
