Ácido sulfanílico: estructura, propiedades, síntesis, usos
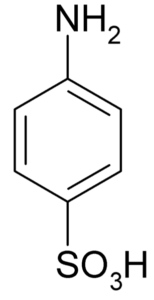
El ácido sulfanílico es un compuesto cristalino cuya molécula está formada por un anillo bencénico al cual están unidos simultáneamente un grupo básico (–NH2) y un grupo ácido (–SO3H). Su fórmula química es NH2C6H4SO3H.
Se le conoce también como ácido 4-aminobencenosulfónico. Se prepara mediante la sulfonación de la anilina en la posición para. Sus cristales son blancos o blanco-grisáceos. Su comportamiento es más parecido al de una sal que al de un compuesto orgánico con los grupos NH2 o –SO3H. Por lo tanto, es insoluble en la mayoría de los solventes orgánicos.
Uno de sus principales usos es en la síntesis de colorantes, pues forma fácilmente un diazocompuesto que es materia prima para esa aplicación.
Tanto el ácido sulfanílico como sus derivados han sido usados como agentes antibacteriales. Se emplea en la síntesis de compuestos mucolíticos, ya que tienen la capacidad de disminuir la viscosidad del moco o fluidos biológicos muy viscosos.
También es utilizado en la industria del papel y en fórmulas para grabados o litografías. Forma parte de resinas que se emplean en mezclas de concreto o morteros para permitir que mantengan su fluidez por largo tiempo, sin influir en el tiempo de fraguado final.
Es un metabolito xenobiótico, esto significa que no es producido naturalmente por los seres vivos. Es irritante de piel, ojos y mucosas. Además, puede contaminar el ambiente.
Índice del artículo
El ácido sulfanílico posee cristales blancos formados por láminas ortorrómbicas o monoclínicas. Su monohidrato cristaliza en agua en forma de láminas ortorrómbicas. Si la cristalización se realiza de manera muy lenta, cristaliza el dihidrato. El monohidrato se vuelve anhidro cuando está cerca de 100 ºC.
– Ácido sulfanílico.
– Ácido p-aminobencenosulfónico.
– Ácido 4-aminobencenosulfónico.
Sólido cristalino blanco o blanco-grisáceo.
173,19 g/mol.
Se descompone a cerca de 288 ºC sin fundirse. También se reporta a >320 ºC.
1,49 g/cm3
Casi insoluble en agua: 10,68 g/L a 20 ºC.
Insoluble en etanol, benceno y éter. Ligeramente soluble en metanol caliente.
Soluble en soluciones acuosas de bases. Insoluble en soluciones acuosas de ácidos minerales. Soluble en ácido clorhídrico concentrado.
Sus propiedades difieren de las de otros compuestos amínicos o sulfonados, siendo parecidas a las de una sal. Esto se debe a que realmente su estructura contiene los grupos –NH3+ y –SO3–, lo que le da características de ion dipolar.
Contiene un grupo ácido y un grupo básico en polos opuestos de la misma molécula. Pero el ion hidrógeno está unido al nitrógeno en lugar del oxígeno porque el grupo –NH2 es una base más fuerte que el grupo –SO3–.
Por ser un ion dipolar presenta un alto punto de fusión e insolubilidad en solventes orgánicos.
El ácido sulfanílico es soluble en solución alcalina porque el ion hidróxido OH–, siendo fuertemente básico, arranca un ion hidrogeno (H+) del débil grupo básico –NH2, formando el ion p-aminobencenosulfonato, el cual es soluble en agua.
En solución ácida la estructura del ácido sulfanílico no cambia, por lo tanto permanece insoluble.
Cuando se calienta hasta su descomposición emite vapores tóxicos de óxidos de nitrógeno y azufre.
La exposición al ácido sulfanílico puede conducir a síntomas como irritación de la piel, ojos y membranas mucosas. Es un compuesto corrosivo.
Se prepara haciendo reaccionar anilina con ácido sulfúrico (H2SO4) a altas temperaturas. Inicialmente se forma la sal sulfato ácido de anilinio, que al calentarse a 180-200 ºC se reorganiza para formar el anillo sustituido en posición para, pues es el producto más estable.
Para prepararlo con alto grado de pureza se realiza la sulfonación de una mezcla de la anilina y sulfolano con H2SO4 a 180-190 ºC.
El ácido sulfanílico se emplea en la síntesis o preparación de varios colorantes, como el anaranjado de metilo y la tartrazina. Para ello se diazotiza, generando el ácido sulfanílico diazotizado.
Es importante resaltar que la tartrazina se ha empleado como colorante en alimentos. Pero una vez ingerida, genera en el organismo humano ciertos metabolitos, entre ellos el ácido sulfanílico, que son los posibles responsables de la formación de especies de oxígeno reactivo. Estos pueden afectar los tejidos renales (riñones) o hepáticos (hígado).

Se emplea como reactivo en la determinación de varios compuestos químicos, entre ellos los nitritos.
La sulfanilamida, derivado del ácido sulfanílico, tiene aplicación en la industria farmacéutica pues presenta actividad antibacterial.
En el cuerpo humano las bacterias la confunden con el ácido p-aminobenzoico que es un metabolito esencial. Esta sustitución hace que las bacterias no se reproduzcan y mueran.
Otro derivado del ácido sulfanílico, obtenido por condensación con otros compuestos, también posee propiedades antibacteriales, las cuales se basan en su habilidad para desplazar el ácido fólico (miembro del complejo vitamínico B).
Este compuesto puede tomarse oralmente, inyectado de forma intravenosa o aplicado externamente en un ungüento.
Se ha utilizado un derivado del ácido sulfanílico que posee actividad mucolítica. Esto es que presenta actividad licuefactiva del moco, para disolver el propio moco o fluidos biológicos muy viscosos.
El compuesto puede emplearse para producir licuefacción del moco producido por un tejido debido a condiciones patológicas. Por ejemplo la congestión del sistema respiratorio o el proveniente del tracto vaginal, entre otros.
Cuando se trata de licuefacción de moco en el tracto respiratorio, el producto se administra por inhalación, gotas en la nariz, rocío, aerosoles o nebulizadores. Es un tratamiento aplicable al ser humano o mamíferos. Es un compuesto más potente que los basados en cisteína.

También se utiliza en el laboratorio cuando se desea reducir la viscosidad de fluidos biológicos para facilitar determinaciones analíticas.
El ácido sulfanílico diazotizado (un derivado que se prepara haciendo reaccionar el ácido sulfanílico con nitrito de sodio) se emplea en la determinación de bilirrubina.
La bilirrubina es un pigmento amarillo que se encuentra en la bilis. El exceso de bilirrubina en la sangre es consecuencia de enfermedades del hígado, desórdenes hematológicos (o de la sangre) o desórdenes en el tracto biliar.
Para medir la cantidad de bilirrubina en sangre se hace reaccionar el diazo derivado del ácido sulfanílico con bilirrubina para formar el complejo azobilirrubina, de cuyo color se mide la intensidad con un colorímetro o un espectrofotómetro. De esta forma, se determina el contenido de bilirrubina en suero sanguíneo.
El ácido sulfanílico permite sintetizar un abrillantador de papel, es decir, un compuesto que le proporciona brillo óptico o apariencia blanca, pues neutraliza el color amarilloso del papel natural o no-tratado.

Tiene la ventaja sobre otros compuestos, ya que puede ser utilizado en concentraciones relativamente altas para tratar la pulpa de papel bajo condiciones de pH bajo, sin aumentar la amarillosidad del papel.
El resultado se evidencia cuando el papel se observa con luz UV (ultravioleta), bajo la cual fluoresce mucho más que cuando se usan otros compuestos, y con luz visible se observa que el grado de amarillosidad es muy bajo.
Es muy soluble en agua, lo que permite usarlo en soluciones más concentradas. Puede utilizarse en cualquier tipo de papel, incluyendo el papel producido de pulpa de madera molida, pulpa de sulfito o de cualquier otro proceso.
El ácido sulfanílico funciona como acidificante en soluciones concentradas para litografía, sin presentar los problemas de otros ácidos como el fosfórico, siendo menos tóxico y menos contaminante que este último.
Las soluciones acuosas de resina melamina-formaldehido modificadas con ácido sulfanílico han sido probadas en concreto (hormigón), mortero o pasta de cemento. La finalidad ha sido reducir el contenido de agua y prevenir la disminución de la fluidez de la mezcla con el paso del tiempo, sin que disminuya el tiempo de fraguado.
El concreto o mortero preparado con dichas soluciones resulta muy efectivo en verano, cuando la disminución de fluidez con el tiempo constituye un problema.
Con estas soluciones, si el mortero o concreto se prepara y por cualquier razón debe dejarse reposando, la composición de cemento puede ser fácilmente vertida en moldes o similares, pues no ha perdido fluidez con el tiempo.

- Windholz, M. et al. (editors) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs and Biologicals. Tenth Edition. Merck & CO., Inc.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 2. Fourth Edition. John Wiley & Sons.
- National Library of Medicine. (2019). Sulfanilic acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Urist, H. and Martin, G.J. (1950). Sulfanilic acid derivatives. US Patent No. 2,504,471. Assignors to The National Drug Company. April 18, 1950.
- Villaume, Frederick G. (1964). Brightener composition for paper derived from metanilic and sulfanilic acids. US Patent No. 3,132,106. May 5, 1964.
- Martin, Tellis A. and Comer, William T. (1979). Benzoic acid derivative and benzenesulfonic acid mucolytic process. US Patent No. 4,132,802. January 2, 1979.
- Druker, L.J. and Kincaid, R.B. (1979). Lithographic fountain concentrate. US Patent No. 4,150,996. April 24, 1979.
- Shull, Bruce C. (1983). Bilirubin assay. US Patent No. 4,404,286. September 13, 1983.
- Uchida, J. et al. (2001). Process for preparing an aqueous solution of sulfanilic acid modified melamine-formaldehyde resin and a cement composition. US Patent No. 6,214,965 B1. April 10, 2001.
- Corradini, M.G. (2019). Volume 1. In Encyclopedia of Food Chemistry. Recuperado de sciencedirect.com.
