Factor de necrosis tumoral (TNF): estructura, mecanismo de acción, función
El factor de necrosis tumoral (TNF), también conocido como caquectina, es una proteína producida naturalmente en las células fagocíticas o macrófagos del cuerpo humano y de otros animales mamíferos. Es una citoquina muy importante que participa tanto en procesos fisiológicos normales como en diversidad de procesos patológicos corporales.
Su descubrimiento data de hace poco más de 100 años, cuando W. Coley empleó extractos bacterianos crudos para tratar tumores en distintos pacientes y encontró que dichos extractos tenían la capacidad de inducir la necrosis de estos tumores, al mismo tiempo que desencadenaban una reacción inflamatoria sistémica en los pacientes.
El principal estimulador “pro-inflamatorio” activado por los extractos bacterianos empleados por Coley fue identificado en 1975, al demostrarse que un factor proteico en el suero de los pacientes tratados causaba la lisis tumoral, de donde surgió el nombre que identifica a este grupo de proteínas (TNF-α).
Aproximadamente 10 años después, en 1984, el gen del “factor de necrosis tumoral” fue aislado y caracterizado, y por la misma fecha se aisló y purificó otra proteína similar en los linfocitos T, a la cual se denominó “linfotoxina T alfa” (TLα), que posteriormente fue renombrada como factor TNF-β.
En la actualidad se han definido numerosas proteínas similares al TNF originalmente descrito, las cuales conforman la familia de proteínas TNF (tipo factor de necrosis tumoral) y en la cual se incluyen las proteínas TNF-α, TNF-β, el ligando CD40 (CD40L), el ligando Fas (FasL) y muchas otras.
Índice del artículo
El gen codificante para la proteína TNF-α se encuentra en el cromosoma 6 (cromosoma 17 en roedores) y el que codifica para la proteína TNF-β precede al anterior en ambos casos (humanos y roedores). Estos dos genes se encuentran en una sola copia y tienen un tamaño aproximado de 3 kb.
En vista de que la secuencia correspondiente a la región promotora del gen TNF-α posee varios sitios de unión para un factor de transcripción conocido como el “factor nuclear kappa B” (NF-κB), muchos autores consideran que su expresión depende de este factor.
La región promotora del gen TNF-β, por otra parte, posee una secuencia de unión para otra proteína conocida como “grupo de alta movilidad 1” (HMG-1, del inglés High Mobility Group 1).
Se han descrito dos formas del factor de necrosis tumoral alfa, una que se encuentra unida a la membrana (mTNF-α) y otra que siempre es soluble (sTNF-α). El factor de necrosis tumoral beta, en cambio, existe únicamente en una forma soluble (sTNF-β).
En los seres humanos, la forma membranal del TNF-α consiste en un polipéptido de poco más de 150 residuos aminoacídicos, los cuales están unidos a una secuencia “líder” de 76 aminoácidos adicionales. Tiene un peso molecular aparente de unos 26 kDa.
La translocación de esta proteína hacia la membrana ocurre durante su síntesis y esta forma es “convertida” en la forma soluble (17 kDa) por una enzima conocida como “la enzima convertidora de TNF-α”, capaz de transformar mTNF-α en sTNF-α.
Las proteínas pertenecientes al grupo del factor de necrosis tumoral (TNF) ejercen sus funciones principalmente gracias a su asociación con receptores específicos en las células del cuerpo humano y de otros animales.
Existen dos tipos de receptores para las proteínas TNF en las membranas plasmáticas de gran parte de las células corporales, con excepción de los eritrocitos: los receptores tipo I (TNFR-55) y los receptores tipo II (TNFR-75).
Ambos tipos de receptores comparten una homología estructural respecto al sitio de unión extracelular para las proteínas TNF y también se unen a estas con una afinidad equivalente. Difieren, entonces, en las rutas de señalización intracelulares que activan una vez ha ocurrido el proceso de unión de ligando-receptor.
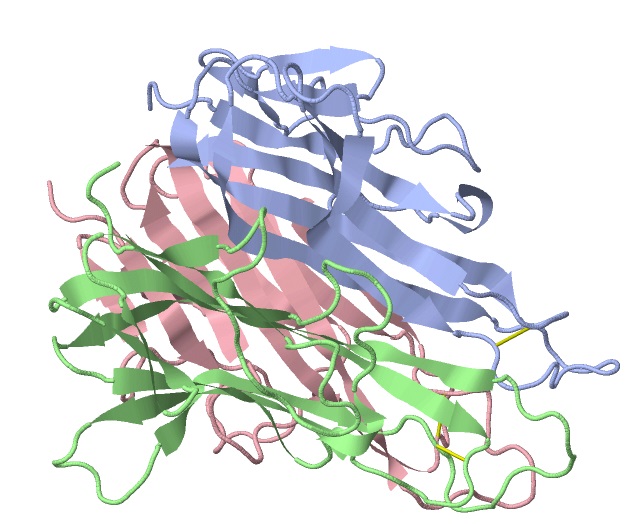
La interacción ligando-receptor del TNF con cualquiera de sus receptores promueve la unión de tres receptores a un trímero soluble del TNF-α (trimerización de los receptores), y dicha interacción desencadena las respuestas celulares aun cuando solo 10% de los receptores están ocupados.
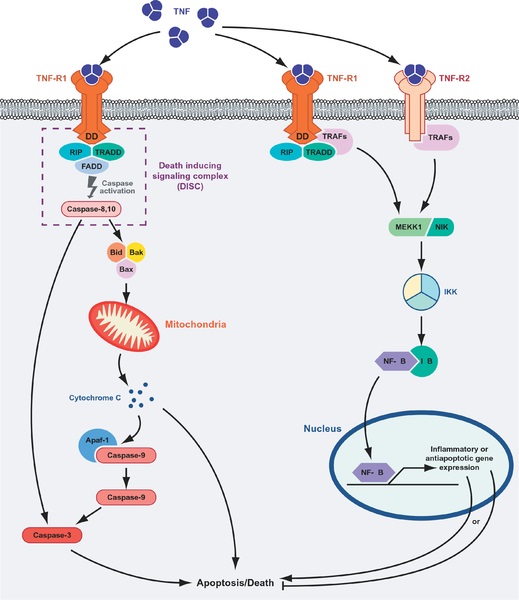
La unión ligando-receptor con los receptores tipo I sirve como “plataforma de reclutamiento” de otras proteínas señalizadoras en los dominios citosólicos de los receptores (la porción interna). Entre estas proteínas, la primera en “llegar” es la proteína TRADD o proteína con dominio de muerte asociada con el receptor TNFR-1 (del inglés TNFR-1-associated death domain protein).
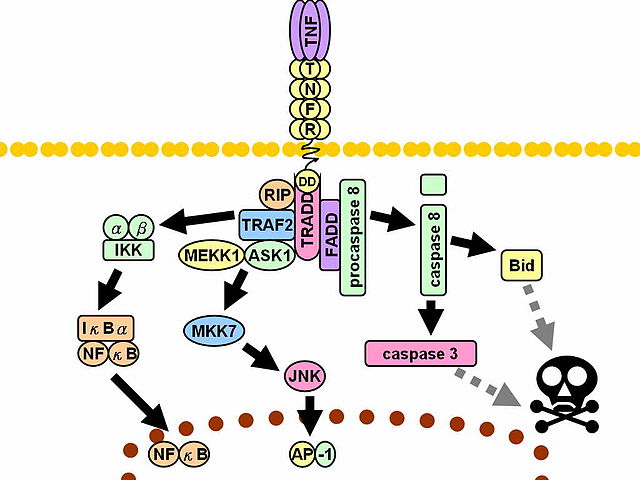
Posteriormente se reclutan otros tres mediadores adicionales: la proteína de interacción con el receptor 1 (RIP1, del inglés Receptor-interacting protein 1), la proteína con dominio de muerte asociada a Fas (FADD, del inglés Fas-associated death domain protein) y el factor 2 asociado con el receptor de TNF (TRAF2, del inglés TNF-receptor-associated Factor 2).
Cuando el TNF se une a los receptores tipo II, esto resulta en el reclutamiento directo de la proteína TRAF2, que recluta a su vez a la proteína TRAF1. Estas proteínas activan las rutas de las proteínas MAPK (del inglés Mitogen-activated Protein Kinase), muy importantes desde el punto de vista de señalización intracelular en los eucariotas.
Muchas de las rutas de señalización que son activadas tras la unión de los factores TNF a sus receptores se relacionan también con la activación de factores de transcripción específicos, los cuales desencadenan las respuestas comunes que han sido descritas como “efectos” biológicos de las proteínas TNF.
La proteína TNF-α es producida principalmente por los macrófagos del sistema inmune, mientras que la proteína TNF-β es producida por los linfocitos T. Sin embargo, se ha demostrado que otras células del cuerpo también producen estos factores, aunque en menor proporción.
El factor de necrosis tumoral ha sido muy estudiado por sus implicaciones en procesos fisiológicos normales, así como en procesos patológicos inflamatorios agudos y crónicos, en enfermedades autoinmunes y en procesos inflamatorios relacionados con diversos tipos de cáncer.
Estas proteínas se vinculan con la rápida pérdida de peso en los pacientes que sufren infecciones bacterianas agudas, que padecen de cáncer y que pasan por un “choque” séptico.
Tres actividades biológicas diferentes han sido descritas para el factor de necrosis tumoral:
– citotoxicidad frente a células tumorales
– supresión de la lipoproteína lipasa de los adipocitos (LPL) y
– reducción del potencial de reposo de la membrana de los miocitos (células musculares).
La forma membranal del TNF-α promueve la citotoxicidad y ha sido implicada en las actividades paracrinas del TNF en ciertos tejidos.
Cuando un estímulo como una endotoxina bacteriana es percibido, esta forma es cortada proteolíticamente en un polipéptido más corto (17 kDa), el cual puede asociarse no covalentemente con otros tres polipéptidos iguales y formar un trímero con forma de campana que corresponde a la forma más activa del TNF en el suero y otros fluidos corporales.
Entre sus funciones biológicas, las proteínas TNF pueden contribuir, además, en la activación y migración de linfocitos y leucocitos, así como promover la proliferación celular, la diferenciación y la apoptosis.
Muchos médicos tratantes recetan inhibidores de las proteínas TNF a pacientes con enfermedades autoinmunes (terapia anti-TNF). Entre estas sustancias están: infliximab, etanercept, adalimumab, golimumab y certolizumab pegol.
La forma de uso más común es mediante inyecciones subcutáneas en los muslos o el abdomen, e incluso se practica la infusión venosa directa. A pesar de lo mucho que algunas de estas sustancias puedan ayudar a determinados pacientes, existen algunos efectos adversos asociados con su uso, entre los que destacan un incremento en el riesgo de contraer infecciones como la tuberculosis u otras infecciones fúngicas.
Algunos fragmentos “cortados” de los receptores membranales de las proteínas TNF (tipo I y tipo II) han también conocidos como las proteínas de unión al TNF (TNF-BPs, del inglés Tumor Necrosis Factor Binding Proteins) han sido detectadas en la orina de pacientes enfermos de cáncer, sida o sepsis.
En algunos casos, estos fragmentos inhiben o neutralizan la actividad de las proteínas TNF, pues evitan la interacción ligando-receptor.
Otros inhibidores “naturales” de las proteínas TNF se han detectado en algunos productos vegetales derivados de la cúrcuma y la granada, aunque aún se realizan estudios al respecto.
- Baud, V., & Karin, M. (2001). Signal transduction by tumor necrosis factor and its relatives. Trends in cell biology, 11(9), 372-377.
- Chu, W. M. (2013). Tumor necrosis factor. Cancer letters, 328(2), 222-225.
- Kalliolias, G. D., & Ivashkiv, L. B. (2016). TNF biology, pathogenic mechanisms and emerging therapeutic strategies. Nature Reviews Rheumatology, 12(1), 49.
- Lis, K., Kuzawińska, O., & Bałkowiec-Iskra, E. (2014). Tumor necrosis factor inhibitors–state of knowledge. Archives of medical science: AMS, 10(6), 1175.
- Tracey, MD, K. J., & Cerami, Ph. D, A. (1994). Tumor necrosis factor: A pleiotropic cytokine and therapeutic target. Annual review of medicine, 45(1), 491-503.
- Wu, H., & Hymowitz, S. G. (2010). Structure and function of tumor necrosis factor (TNF) at the cell surface. In Handbook of cell signaling (pp. 265-275). Academic Press.
