Acetato de isoamilo: estructura, propiedades, síntesis y usos
El acetato de isoamilo es un éster cuya fórmula molecular es CH3COO(CH2)2CH(CH3)2. A temperatura ambiente consiste de un líquido aceitoso, claro, incoloro, inflamable y volátil. De hecho, es un éster demasiado volátil y fragante.
Su principal característica es la de despedir un olor que contribuye al aroma de muchas frutas, especialmente el de las del banano o plátano. Asimismo, este último fruto constituye una de sus fuentes naturales por excelencia.

De allí el nombre de aceite de plátano que se da a una solución de acetato de isoamilo, o a una mezcla de acetato de isomilo con nitrocelulosa. El compuesto es ampliamente usado como saborizante de alimentos, helados y golosinas.
Además, se usa en la elaboración de fragancias con empleos diferentes. También es un solvente empleado en la extracción de metales y compuestos orgánicos como el ácido acético.
El acetato de isoamilo es el resultado de la esterificación del alcohol isoamílico con el ácido acético. En los laboratorios de docencia de química orgánica, esta síntesis representa una experiencia interesante para poner en práctica la esterificación, a la vez que se inunda el laboratorio con fragancia de banana.
Índice del artículo
- 1 Estructura del acetato de isoamilo
- 2 Propiedades
- 2.1 Nombres químicos
- 2.2 Fórmula molecular
- 2.3 Peso molecular
- 2.4 Descripción física
- 2.5 Olor
- 2.6 Sabor
- 2.7 Punto de ebullición
- 2.8 Punto de fusión
- 2.9 Punto de ignición
- 2.10 Solubilidad en agua
- 2.11 Solubilidad en solventes orgánicos
- 2.12 Densidad
- 2.13 Densidad de vapor
- 2.14 Presión de vapor
- 2.15 Temperatura de auto ignición
- 2.16 Viscosidad
- 2.17 Calor de combustión
- 2.18 Umbral de olor
- 2.19 Índice de refracción
- 2.20 Velocidad relativa de evaporación
- 2.21 Constante dialéctrica
- 2.22 Almacenamiento
- 3 Síntesis
- 4 Usos
- 5 Riesgos
- 6 Referencias
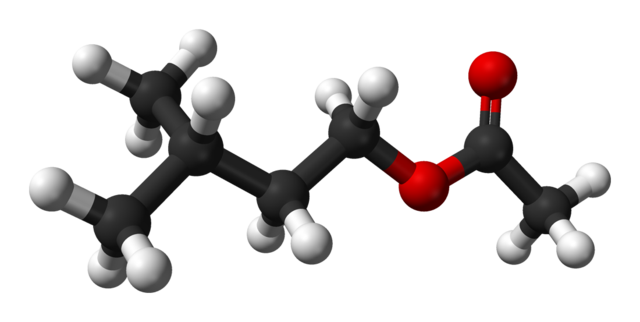
En la imagen superior se tiene la estructura molecular del acetato de isoamilo mediante un modelo de esferas y barras. Las esferas rojas corresponden a los átomos de oxígeno, específicamente los que identifican a este compuesto como un éster; su porción de éter, R-O-R, y el grupo carbonilo, C=O, teniendo entonces la fórmula estructural R’COOR.
A la izquierda, R’, se tiene el radical alquílico isopentil, (CH3)2CHCH2CH2; y a la derecha, R, al grupo metilo, al cual se le debe el ‘acetato’ del nombre de este éster. Es un éster relativamente pequeño, capaz de interactuar con los receptores químicos del olfato de nuestras narices, ocasionando señales que el cerebro interpreta como fragancia.
La molécula del acetato de isoamilo en sí es flexible; pero, el radical isopentil no beneficia a las interacciones intermoleculares por estar ramificado, impidiendo estéricamente que los átomos de oxígeno interactúen eficientemente mediante fuerzas dipolo-dipolo.
Asimismo, estos dos oxígeno no pueden aceptar puentes de hidrógeno; estructuralmente la molécula no tiene cómo donarlos. Frente a los interrumpidos dipolos, el acetato de isoamilo puede interaccionar intermolecularmente mediante las fuerzas de dispersión de London; las cuales, son directamente proporcionales a su masa molecular.
Siendo así, es la masa molecular del éster la responsable de que sus moléculas formen un líquido con elevado punto de ebullición (141°C). Igualmente, es responsable de que su sólido funda a una temperatura de -78°C.
Sus fuerzas intermoleculares son tan débiles, que el líquido es lo suficiente volátil para impregnar sus alrededores con olores de bananas. Curiosamente, el olor dulce de este ester puede cambiar si se reduce o aumenta el número de carbonos.
Es decir, si en lugar de tener seis carbonos alifáticos tuviera cinco (con el radical isobutil) su olor se asemejaría al de las frambuesas; si el radical fuera el secbutil, el olor se cargaría con rastros de solventes orgánicos; y si tuviera más de seis carbonos, el olor comenzaría a tornarse jabonoso y metálico.
-Acetato de isoamilo
-Etanoato de isopentilo
-Acetato de 3-metilbutilo
-Acetato de isopentilo
-Aceite de banana o plátano.
C7H14O2 o CH3COO(CH2)2CH(CH3)2
130,187 g/mol.
Es un líquido aceitoso, claro e incoloro.
A temperatura ambiente tiene un olor intenso y agradable a banana.
Tiene un sabor semejante al que presenta la pera y la manzana.
124,5 ºC.
-78,5 ºC.
Copa cerrada 92 ºF (33 ºC); copa abierta 100 ºF (38 ºC).
2.000 mg/L a 25 ºC.
Miscible con alcohol, éter, acetato de etilo y alcohol amílico.
0,876 g/cm3.
4,49 (en relación al aire = 1).
5,6 mmHg a 25 ºC.
680 ºF (360 ºC).
-1,03 cPoise a 8,97 ºC
-0,872 cPoise a 19,91 ºC.
8.000 cal/g.
Aire = 0,025 µL/L
Agua = 0,017 mg/L.
1,400 a 20 ºC.
0,42 (en relación al acetato de butilo = 1).
4,72 a 20 ºC.
El acetato de isoamilo es un compuesto inflamable y volátil. Por lo tanto, debe guardarse en frío en envases completamente herméticos, lejos de sustancias combustibles.
Es producido por la esterificación del alcohol isoamílico con el ácido acético glacial, en un proceso conocido como esterificación de Fisher. El ácido sulfúrico es usado habitualmente como catalizador, pero también el ácido p-toluenosulfónico cataliza la reacción:
(CH3)2CH-CH2-CH2CH2OH + CH3COOH => CH3COOCH2-CH2-CH2-CH(CH3)2
Se usa para conferir un sabor a pera en agua y en jarabes. Se usa en la China para preparar sabores de frutas, como fresa, mora, piña, pera, manzana, uva y banana. Las dosis utilizadas son: 190 mg/kg en confitería; 120 mg/kg en pastelería; 56 mg/kg en helados; y 28 mg/kg en refrescos.
Es un solvente para:
-La nitrocelulosa y celuloide
-Barnices a prueba de agua
-Goma de éster
-Resina de vinilo
-Resina de cumarona y aceite de ricino.
Se usa como solvente para la determinación de cromo y se emplea como agente de extracción de hierro, cobalto y níquel. También se usa como disolvente de pinturas al óleo y lacas viejas. Además, se usa en la elaboración del esmalte para las uñas.
Este éster se utiliza como diluyente en la producción de ácido acético. El petróleo es usado como materia prima en un proceso de oxidación que produce una solución acuosa de ácido acético y otros compuestos, como el ácido fórmico y el ácido propiónico.
Como solvente y portador de otras sustancias fue utilizado en los comienzos de la industria aeronáutica para proteger las telas de las alas de los aviones.
-Es empleado como ambientador para encubrir los malos olores.
-Se usa como perfume en la laca de los zapatos.
-Para probar la eficiencia de las máscaras antigases, ya que el acetato de isoamilo tiene un umbral de olor muy bajo y es poco tóxico.
-Se usa en la elaboración de fragancias como el Chipre; el osmanthus de aroma suave; el jacinto; y el fuerte sabor oriental, usándose en dosis bajas, inferiores al 1%.
Se emplea en la elaboración de seda y perlas artificiales, películas fotográficas, barnices impermeables y bronceadores. También se utiliza en la industria textil en el teñido y acabado. Se emplea en el lavado en seco de artículos de vestir y muebles de tela.
Además, el acetato de isoamilo es empleado en la elaboración del rayón, una tela sintética; en la extracción de la penicilina, y como una sustancia estándar en cromatografía.
El acetato de isoamilo puede irritar por contacto físico la piel y los ojos. La inhalación puede provocar irritación en la nariz, la garganta y los pulmones. Mientras, la exposición a altas concentraciones puede causar dolor de cabeza, somnolencia, vértigo, mareo, fatiga y desmayo.
El contacto prolongado con la piel puede causar su resequedad y agrietamiento.
- Bilbrey Jenna. (30 de julio de 2014). Isoamyl acetate. Chemistry World by The Royal Society of Chemistry. Recuperado de: chemistryworld.com
- National Center for Biotechnology Information. (2019). Isoamyl acetate. PubChem Database. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Isoamyl acetate. Recuperado de: en.wikipedia.org
- Royal Society of Chemistry. (2015). Isoamyl acetate. Chemspider. Recuperado de: chemspider.com
- New Jersey Department of Health and Senior Services. (2005). Isoamyl acetate. [PDF]. Recuperado de: nj.gov
- Chemical Book. (2017). Isoamyl acetate. Recuperado de: chemicalbook.com
