Ácido yodhídrico (HI): estructura, propiedades y usos
El ácido yodhídrico es una disolución acuosa de yoduro de hidrógeno que se caracteriza por su elevada acidez. Una definición más apegada a la terminología química y de la IUPAC, es que se trata de un hidrácido, cuya fórmula química es HI.
No obstante, para diferenciarlo de las moléculas gaseosas de yoduro de hidrógeno, HI(g), se denota como HI(ac). Es por esta razón que en las ecuaciones químicas es importante identificar el medio o la fase física en la que se hayan los reactivos y productos. Aun así, suele ser común las confusiones entre el yoduro de hidrógeno y el ácido yodhídrico.
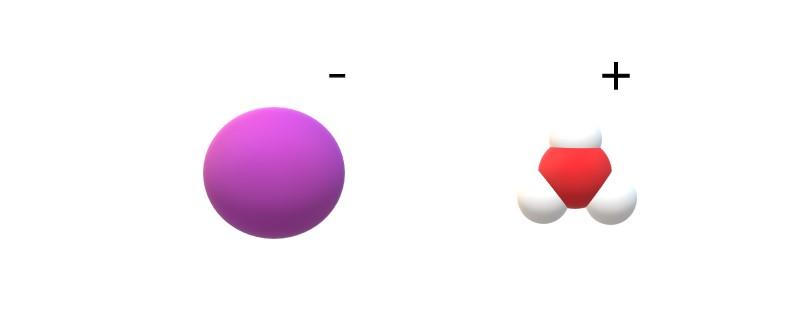
Si se observan las moléculas comprometidas en su identidad se hallará diferencias notorias entre HI(g) y HI(ac). En el HI(g), existe un enlace H-I; mientras que en el HI(ac), son en realidad un par de iones I– y H3O+ interaccionando electrostáticamente (imagen superior).
Por otro lado, el HI(ac) es una fuente de HI(g), ya que el primero se prepara por la disolución del segundo en agua. Debido a esto, a menos que sea en una ecuación química, HI puede utilizarse para referirse también al ácido yodhídrico. El HI es un fuerte agente reductor y una excelente fuente de iones I– en medio acuoso.
Índice del artículo
El ácido yodhídrico, como recién se explicó, consiste de una disolución de HI en agua. Al estar en el agua, las moléculas de HI se disocian completamente (electrolito fuerte), originando los iones I– y H3O+. Esta disociación se puede representar con la siguiente ecuación química:
HI(g) + H2O(l) => I–(ac) + H3O+(ac)
Lo que sería equivalente si se escribiera como:
HI(g) + H2O(l) => HI(ac)
No obstante, HI(ac) no revela en absoluto qué le ha sucedido a las moléculas de HI gaseosas; solo indica que están en medio acuoso.
Por lo tanto, la verdadera estructura del HI(ac) consiste de los iones I– y H3O+ rodeados por moléculas de agua hidratándolos; mientras más concentrado sea el ácido yodhídrico, menor será el número de moléculas de agua sin protonarse.
Comercialmente de hecho la concentración de HI es de 48 a 57% en agua; más concentrado equivaldría a tener un ácido demasiado fumante (y todavía más peligroso).
En la imagen, puede apreciarse que el anión I– se representa con una esfera morada, y H3O+ con esferas blancas y una roja, para el átomo de oxígeno. El catión H3O+ presenta geometría molecular pirámide trigonal (visto desde un plano superior en la imagen).
Líquido incoloro; pero, puede exhibir tonalidades amarillentas y marrones si está en contacto directo con el oxígeno. Esto se debe a que los iones I– terminan oxidándose a yodo molecular, I2. Si hay mucho I2, es más que probable que se forme el anión triyoduro, I3–, el cual tiñe de marrón la solución.
127,91 g/mol.
Acre.
La densidad es de 1,70 g/mL para la solución HI al 57%; ya que, las densidades varían en función de las distintas concentraciones de HI. A esta concentración se forma un azeótropo (se destila como una única sustancia y no como una mezcla) a cuya relativa estabilidad puede que se le deba su comercialización por encima de otras disoluciones.
El azeótropo HI al 57% hierve a 127ºC a una presión de 1,03 bar (PASAR A ATM).
-1,78.
Es un ácido extremadamente fuerte, tanto, que resulta corrosivo para todos los metales y tejidos; hasta para los cauchos.
Esto se debe a que el enlace H-I es muy débil, y se rompe fácilmente durante su ionización en agua. Además, los puentes de hidrógeno I– — HOH2+ son débiles, por lo que no hay nada que interfiera que el H3O+ reaccione con otros compuestos; es decir, el H3O+ se haya “libre”, al igual que el I– que no atrae con demasiada fuerza a su contraion.
El HI es un poderoso agente reductor, cuyo principal producto de reacción es el I2.
La nomenclatura del ácido yodhídrico deriva del hecho de que el yodo “trabaja” con un único estado de oxidación: -1. Y además, el mismo nombre indica que posee agua dentro de su fórmula estructural [I–][H3O+]. Este es su único nombre, al no tratarse de un compuesto puro sino de una disolución.
El HI es una excelente fuente de iones I– para síntesis inorgánicas y orgánicas, y es además un poderoso agente reductor. Por ejemplo, se utiliza su disolución acuosa al 57% para la síntesis de yoduros de alquilo (como el CH3CH2I) a partir de alcoholes primarios. Asimismo, puede sustituir en una estructura un grupo OH por un I.
El ácido yodhídrico se ha utilizado para reducir, por ejemplo, carbohidratos. Si se calienta glucosa disuelta en este ácido, perderá todos sus grupos OH, obteniéndose como producto el hidrocarburo n-hexano.
Asimismo, se ha utilizado para reducir los grupos funcionales de láminas de grafeno, de tal manera que puedan funcionalizarse para dispositivos electrónicos.
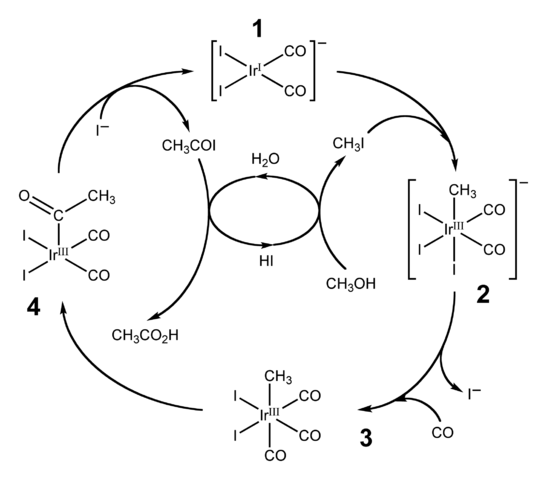
Pasos
El proceso empieza (1) con el complejo organo-iridio [Ir(CO)2I2]–, de geometría plano cuadrado. Este compuesto “recibe” el yoduro de metilo, CH3I, producto de la acidificación del CH3OH con HI al 57%. El agua también se produce en esta reacción, y gracias a ella se obtiene al final el ácido acético, a la vez que permite recuperar el HI en el último paso.
En este paso tanto el grupo –CH3 como el –I se unen al centro metálico de iridio (2), formándose un complejo octaédrico con una faceta compuesta por tres ligandos I. Uno de los yodos termina sustituyéndose por una molécula de monóxido de carbono, CO; y ahora (3), el complejo octaédrico posee una faceta compuesto por tres ligandos CO.
Luego, ocurre un reordenamiento: el grupo –CH3 se “suelta” del Ir y se une al CO adyacente (4) para formar un grupo acetilo, -COCH3. Este grupo se libera del complejo de iridio para enlazarse a los iones yoduros y dar CH3COI, yoduro de acetilo. Aquí se recupera el catalizador de iridio, listo para participar en otro ciclo catalítico.
Finalmente, el CH3COI sufre una sustitución del I– por una molécula de H2O, cuyo mecanismo termina por liberar HI y el ácido acético.
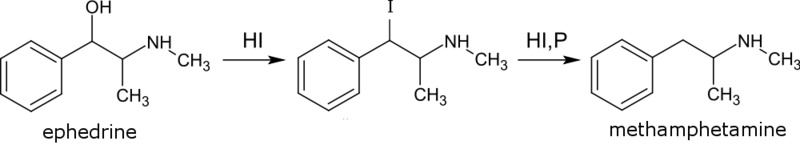
Puede apreciarse que primero ocurre una sustitución del grupo OH por el I, seguido de una segunda sustitución por un H.
- Wikipedia. (2019). Hydroiodic acid. Recuperado de: en.wikipedia.org
- Andrews, Natalie. (24 de abril de 2017). The Uses of Hydriodic Acid. Sciencing. Recuperado de: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodic acid. Recuperado de: alfa.com
- National Center for Biotechnology Information. (2019). Hydriodic acid. PubChem Database., CID=24841. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Illustrated Glossary of Organic Chemistry: Hydroiodic acid. Recuperado de: chem.ucla.edu
- Reusch William. (05 de mayo de 2013). Carbohydrates. Recuperado de: 2.chemistry.msu.edu
- In Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Reduced graphene oxide by chemical graphitization. DOI: 10.1038/ncomms1067.
