Dodecil sulfato de sodio (SDS): estructura, propiedades, usos
El dodecil sulfato de sodio (SDS), es una sal orgánica aniónica, sintética y anfifílica. La parte apolar e hidrofóbica, corresponde a la cadena hidrocarbonada; mientras que la parte polar e hidrofílica, es debida al sulfato, con carga negativa.
El SDS es un surfactante: sus moléculas se colocan sobre la superficie de las soluciones acuosas, produciendo una disminución de la tensión superficial. Esta característica permite su uso en champú, cremas dentales, jabones y otros artículos del cuidado personal y de la limpieza del hogar.
El dodecil sulfato de sodio se une a la proteína y produce su desdoblamiento, adquiriendo una forma alargada. Los grupos sulfatos quedan expuestos al agua, adquiriendo las proteínas cargas negativas, cuyo número es proporcional al peso molecular de las mismas.
Por esta razón el SDS permite la determinación de los pesos moleculares de las proteínas mediante la electroforesis en poliacrilamida.
Aunque se ha sospechado un posible efecto carcinogénico del SDS, no se ha demostrado concluyentemente que sea así. El SDS puede producir, al igual que otros detergentes, irritación en la piel y en los ojos.
Índice del artículo
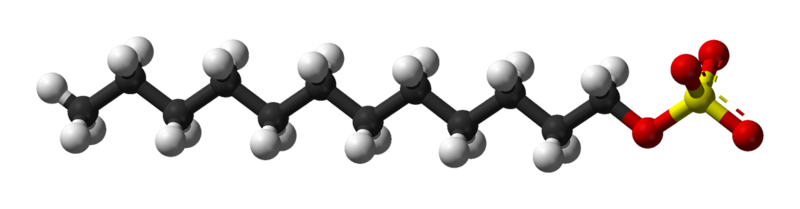
En la primera imagen se mostró la molécula de SDS con un modelo de esferas y barras. Como se aprecia, tiene una cola carbonada hidrofóbica y apolar (esferas negras y blancas); y a la vez, una cabeza polar, gracias a la presencia del grupo -SO4– (esferas amarillas y rojas).
Aunque no se muestre, debería haber una esfera de color morado representando al catión Na+, justo al lado del grupo -SO4–, interaccionando electrostáticamente.
Dicho esto, se comprende a simple vista por qué este compuesto es anfifílico; e igualmente un tensioactivo aniónico, ya que la carga del SDS es negativa y puede atraer otros cationes además del Na+.
La molécula da la falsa impresión de ser rígida, una estructura lineal inamovible. Sin embargo, es todo lo opuesto. El SDS podría compararse a un “gusano”, cuya cola carbonada presenta múltiples vibraciones y rotaciones de sus enlaces simples. Esto le hace capaz de adoptar distintas conformaciones o dobleces en el medio; en agua, por ejemplo.
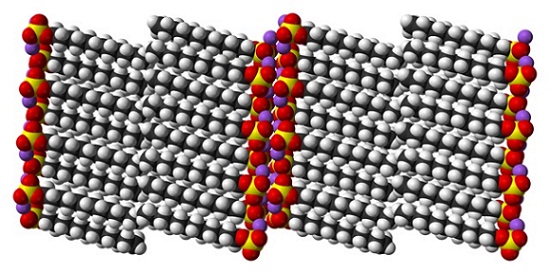
Si bien es cierto que el dodecil sulfato de sodio es una molécula dinámica, en el estado sólido no tiene necesidad de moverse demasiado, comportándose como una “simple” barra. Y así, cada molécula o barra se posicionan de tal modo que incrementen las interacciones entre las colas carbonadas y, al mismo tiempo, las de sus cargas iónicas.
El resultado es la formación de un cristal monoclínico, donde las moléculas de SDS se empaquetan en varias columnas de barras (imagen superior). Las fuerzas intermoleculares que las unen son tales, que estos cristales requieren de una temperatura de 206ºC para fundirse a la fase líquida.
Fuera de la comodidad de sus cristales, la molécula de SDS ya no puede quedarse quieta; empieza a retorcer su cola para aumentar o disminuir las interacciones con el medio exterior.
Si este medio es el agua, ocurre un fenómeno llamado formación de micelas: las colas carbonadas e hidrofóbicas se unen para acorazarse, mientras que las cabezas polares, los grupos -SO4–, permanecen en la superficie interaccionando con las moléculas de H2O.
Entonces, la micela adquiere una morfología de elipsoide oblato (como la Tierra, pero más aplastada). En el cristal están como bloques de barras, y en un medio acuoso como micelas elipsoides. ¿Y si el medio fuera aceitoso? La micela se invertiría: las cabezas polares SO4– irían al núcleo, mientras que sus colas carbonadas quedarían expuestas al aceite.
– Dodecilsulfato sódico (SDS).
– Laurilsulfato sódico (SLS).
C12H25O4SNa.
288,378 g/mol.
Varias presentaciones: polvo seco, líquido o sólido húmedo. Sus cristales presentan una coloración blanca o cremosa.
Olor tenue de las sustancias grasas, inodoro.
206 ºC.
1·105 mg/L. 1 g disuelto en 10 mL de una solución opalescente.
1,01 g/cm3.
Es estable bajo las condiciones de almacenamiento recomendadas.
Cuando se calienta a descomposición emite un humo blanco de óxido de azufre y óxido de sodio.
39,5 dinas/cm a 25 ºC.
Es 8,2 mM en agua pura a 25 ºC.
El dodecil sulfato es un surfactante que se usa en numerosos productos, como jabones de tocador, baños de espumas, cremas de afeitar, etc. Asimismo, se utiliza para eliminar manchas de ropas difíciles de eliminar, en limpieza de los pisos y los baños, fregados de los artículos de la cocina, etc.
Se emplea como repelente de las pulgas y garrapatas, presente en animales. También se utiliza como humectante en algunos antibióticos, para uso oral o tópico.
El SDS es microbicida contra los virus con envoltura, como el VIH, tipos 1 y 2, y el virus del herpes simple (HSV-2). También actúa sobre virus sin envoltura: el papilomavirus, reovirus, rotavirus y poliovirus. Sin embargo, este uso no está aprobado.
Se ha sugerido el uso del SDS como ducha vaginal que suministre protección contra virus de transmisión sexual. Asimismo, en el procesamiento de la leche materna para eliminar o disminuir la posibilidad de la transmisión del VIH vía lactancia materna.
Además de su acción antiviral, el SDS actúa sobre bacterias y hongos patógenos. El SDS elimina los factores de resistencia a las drogas y de transferencia de sexos de la E. coli; y bloquea el crecimiento de numerosas bacterias Gram positivas.
El SDS se une a las proteínas provocando su desnaturalización, suministrándoles cargas negativas y un cambio conformacional. Esto permite la determinación de sus pesos moleculares mediante la electroforesis en poliacrilamida.
También se utiliza el SDS en la preparación de las muestras de tejido cerebral para su uso en microscopía óptica. Además se emplea en la preparación de las muestras de sangre para el contaje del número de eritrocitos.
El SDS es usado en la purificación de los ácidos nucleicos, debido a su capacidad para disolver las membranas y su acción inhibitoria sobre la actividad de las enzimas ARNasa y DNAasa.
Además, el SDS es usado en la caracterización de compuestos de amonio cuaternarios.
El SDS se usa como emulsionante y espesante de los alimentos. Mejora la estabilidad y la textura de los productos horneados. Adicionalmente, se emplea como auxiliar en el batido de productos de huevo seco.
El SDS se emplea en la industria de la galvanoplastia, particularmente del níquel y cinc; como emulsionante y penetrante en barniz y removedor de pintura; en la formulación de explosivos moldeados por inyección; y en los propulsores sólidos de cohetes como espumante.
La exposición constante a SDS puede provocar hiperplasia de la piel en cobayas. El conejo y los seres humanos son menos susceptibles a estas lesiones. El contacto directo con SDS a una concentración ≤ 20%, puede causar inflamación moderada e irritación de la piel.
Por otro lado, la exposición prolongada al SDS puede producir dermatitis, con signos de enrojecimiento, hinchazón y formación de ampollas.
El SDS puede producir por contacto irritación ocular. Puede además ser muy reactivo en algunas personas, y causar por inhalación irritación de las vías respiratorias y dificultad respiratoria.
En raras ocasiones, la ingestión de SDS puede provocar lesiones cáusticas. Pero, ha sido reportado en niños que han ingerido SDS, vómitos profusos de rápido desarrollo, depresión del SNC y dificultad respiratoria.
No se han encontrado evidencias de genotoxicidad o de acción teratogénica en el SDS. En 242 pacientes con dermatitis eccematosa se halló un 6,4 % de los pacientes con alergia, atribuible al uso del SDS.
- Structural data from L. A. Smith, R. B. Hammond, K. J. Roberts, D. Machin, G. McLeod (2000). Determination of the crystal structure of anhydrous sodium dodecyl sulphate using a combination of synchrotron radiation powder diffraction and molecular modelling techniques. Journal of Molecular Structure 554 (2-3): 173-182. DOI:10.1016/S0022-2860(00)00666-9.
- Wikipedia. (2019). Sodium dodecyl sulfate. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Sodium dodecyl sulfate. PubChem Database. CID=3423265. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Hammouda B. (2013). Temperature Effect on the Nanostructure of SDS Micelles in Water. Journal of research of the National Institute of Standards and Technology, 118, 151–167. doi:10.6028/jres.118.008
- Elsevier. (2019). Sodium Dodecyl Sulfate. Science Direct. Recuperado de: sciencedirect.com
- Kumar, S., Thejasenuo, J. K. y Tsipila, T. (2014). Toxicological effects of sodium dodecyl sulfate. Journal of Chemical and Pharmaceutical Research 6(5): 1488 – 1492.
- Toxicology Data Network. (s.f.). Sodium lauryl sulfate. Toxnet. Recuperado de: toxnet.nlm.nih.gov
