Curva de calentamiento: qué es, cómo se hace, ejemplos
Una curva de calentamiento es la representación gráfica de cómo varía la temperatura de una muestra en función del tiempo, manteniendo la presión constante y agregando calor uniformemente, es decir, a tasa constante.
Para construir una gráfica de este tipo, se van tomando parejas de valores de temperatura y tiempo, que posteriormente se grafican colocando la temperatura en el eje vertical (ordenadas) y el tiempo en el eje horizontal (abscisas).

Luego se ajusta la curva más apropiada a estos puntos experimentales y finalmente se obtiene una gráfica de la temperatura T como función del tiempo t: T (t).
Índice del artículo
- 1 ¿En qué consiste la curva de calentamiento?
- 2 ¿Cómo se hace una curva de calentamiento?
- 3 Ejemplos (agua, hierro…)
- 4 Referencias
A medida que se calienta, una sustancia va atravesando sucesivamente diversos estados: de ser sólido puede pasar a vapor, casi siempre pasando por el estado líquido. A estos procesos se los denomina cambios de estado, en los cuales la muestra va incrementando su energía interna mientras se le agrega calor, tal como señala la teoría cinético molecular.
Al añadir calor a una muestra existen dos posibilidades:
– La sustancia aumenta su temperatura, en vista de que sus partículas se agitan con mayor intensidad.
– El material está pasando por un cambio de fase, en el cual la temperatura se mantiene constante. Añadir calor tiene el efecto de debilitar en cierta medida las fuerzas que mantienen cohesionadas a las partículas, por esto es fácil pasar de hielo a agua líquida, por ejemplo.
En la figura 2 se muestran los cuatro estados de la materia: sólido, líquido, gas y plasma, y los nombres de los procesos que permiten la transición entre unos y otros. Las flechas indican el sentido del proceso.
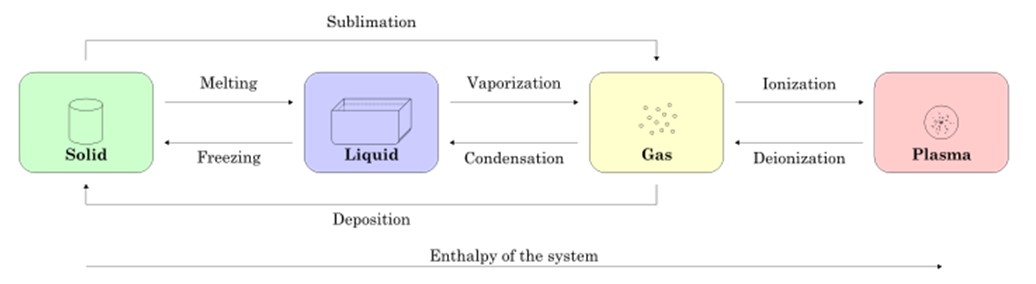
Comenzando por una muestra en estado sólido, al fundirse pasa al estado líquido, al vaporizarse pasa a convertirse en gas y mediante la ionización se convierte en plasma.
Puede que el sólido se convierta directamente en gas mediante el proceso conocido como sublimación. Hay sustancias que subliman fácilmente a temperatura ambiente. El más conocido es el CO2 o hielo seco, así como también el naftaleno y el yodo.
Mientras la muestra atraviesa un cambio de estado, la temperatura se mantiene constante hasta llegar al nuevo estado. Esto significa que si por ejemplo se tiene una porción de agua líquida que ha llegado a su punto de ebullición, su temperatura se mantiene constante hasta que todo el agua se haya convertido en vapor.
Por tal razón se espera que la curva de calentamiento esté compuesta de una combinación de tramos crecientes y tramos horizontales, donde estos últimos corresponden a los cambios fase. En la figura 3 se muestra una de estas curvas para una sustancia dada.
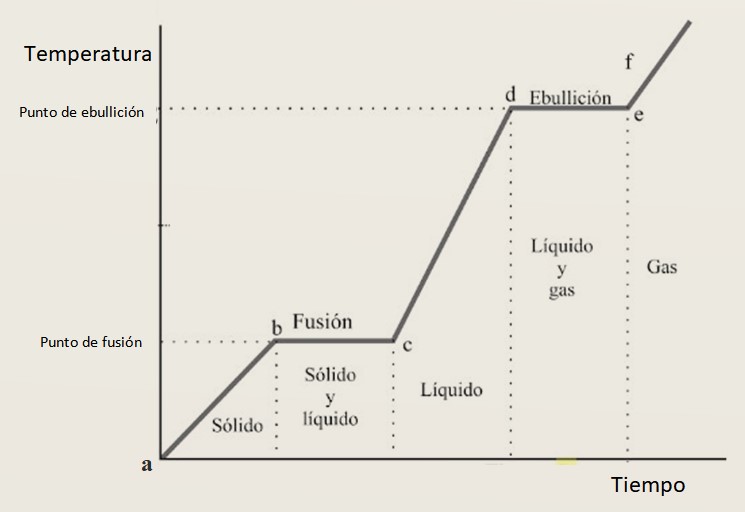
Interpretación de la curva de calentamiento
En los intervalos de crecimiento ab, cd y ef la sustancia se encuentra como sólido, líquido y gas respectivamente. En estas regiones la energía cinética se incrementa y con ella la temperatura.
Mientras que en bc está cambiando su estado de sólido a líquido, por lo tanto las dos fases coexisten. Así sucede en el tramo de, en que la muestra pasa de líquido a gas. Aquí está cambiando la energía potencial, y la temperatura permanece constante.
El procedimiento inverso también es posible, es decir, se puede enfriar la muestra para que adopte sucesivamente otros estados. En tal caso se habla de curva de enfriamiento.
Las curvas de calentamiento tienen el mismo aspecto general para todas las sustancias, aunque desde luego no los mismos valores numéricos. Algunas sustancias requieren más tiempo que otras en cambiar de estado, y funden y vaporizan a distintas temperaturas.
Estos puntos son conocidos respectivamente como punto de fusión y punto de ebullición, y son características propias de cada sustancia.
Por eso las curvas de calentamiento son muy útiles, puesto que indican el valor numérico de estas temperaturas para millones de sustancias que existen como sólidos y líquidos en el rango de temperaturas consideradas normales y a presión atmosférica.
En principio es muy sencillo: basta con colocar una muestra de sustancia en un recipiente provisto de un agitador, introducir un termómetro y calentar uniformemente.
Simultáneamente, al iniciar el procedimiento se activa un cronómetro y cada cierto tiempo se anotan las correspondientes parejas temperatura-tiempo.
La fuente de calor puede ser un mechero a gas, con buena velocidad de calentamiento, o bien una resistencia eléctrica que al calentarse emite calor, la cual puede conectarse a una fuente variable para conseguir distintas potencias.
Para mayor precisión hay dos técnicas muy utilizadas en el laboratorio de química:
– El análisis térmico diferencial.
– La calorimetría diferencial de barrido.
En ellas se compara la diferencia de temperatura entre la muestra bajo estudio y otra muestra de referencia con alta temperatura de fusión, casi siempre un óxido de aluminio. Con estos métodos se busca encontrar fácilmente los puntos de fusión y ebullición.
Considérese las curvas de calentamiento para el agua y para el hierro mostradas en la figura. La escala de tiempo no se muestra, sin embargo es inmediato distinguir las temperaturas de fusión para ambas sustancias que corresponden al punto B de cada gráfica: para el agua 0 º C, para el hierro 1500º C.
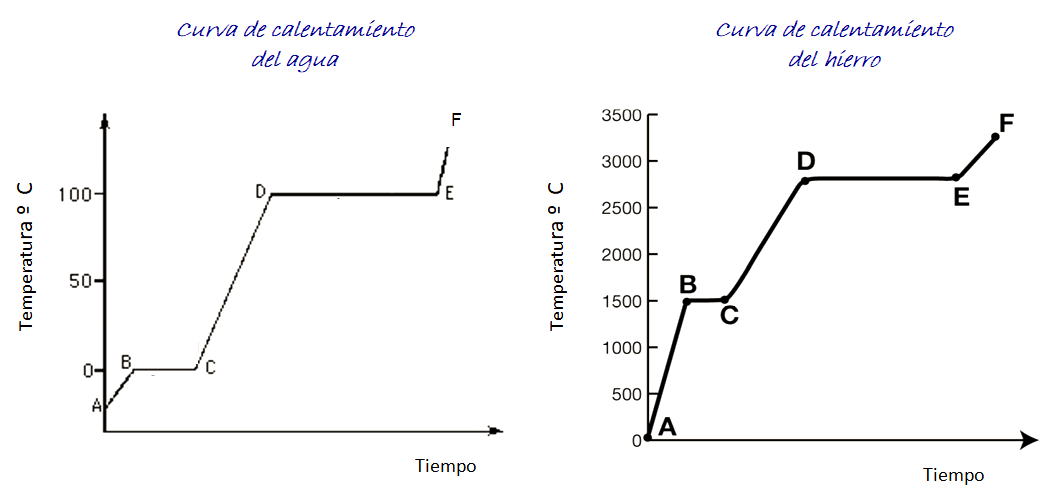
El agua es una sustancia universal y el rango de temperaturas necesario para ver sus cambios de estado es fácil de lograr en el laboratorio. Para el hierro se requieren temperaturas bastante más elevadas, pero tal como se indicó anteriormente, la forma de la gráfica no cambia sustancialmente.
Al calentar la muestra de hielo, de acuerdo a la gráfica nos encontramos en el punto A, a una temperatura por debajo de 0º C. Se observa que la temperatura aumenta a una tasa constante hasta llegar a 0º C.
Las moléculas de agua dentro del hielo vibran con mayor amplitud. Una vez que se llega a la temperatura de fusión (punto B), las moléculas ya pueden moverse unas delante de otras.
La energía que llega se invierte en disminuir la fuerza de atracción entre las moléculas, por eso la temperatura entre B y C permanece constante hasta todo el hielo se ha derretido.
Una vez que el agua se encuentra totalmente en estado líquido, la vibración de las moléculas se incrementa de nuevo y la temperatura aumenta rápidamente entre C y D hasta el punto de ebullición en 100º C. Entre D y E la temperatura permanece en ese valor mientras la energía que llega se encarga de que toda el agua en el recipiente se vaya evaporando.
Si se logra contener todo el vapor de agua en un recipiente, puede seguirse calentando desde el punto E hasta el punto F, cuyo límite no se muestra en la gráfica.
Una muestra de hierro puede atravesar estos mismos cambios. Sin embargo, dada la naturaleza del material, los rangos de temperatura son muy diferentes.
- Atkins, P. Principios de Química: Los Caminos del Descubrimiento. Editorial Médica Panamericana. 219-221.
- Chung, P. Heating curves. Recobrado de: chem.libretexts.org.
- Heating curves. Heat of Fusion and Vaporization. Recobrado de: wikipremed.com.
- Hewitt, Paul. 2012. Conceptual Physical Science. 5th. Ed. Pearson. 174- 180.
- Universidad de Valladolid. Grado en Química, Recobrado de: alojamientos.uva.es.
