Galvanoplastia: proceso, ejemplos, aplicaciones prácticas

¿Qué es la galvanoplastia?
La galvanoplastia o electrodeposición es una técnica electroquímica que consiste, como su nombre sugiere, en depositar capas de metales sobre objetos receptores; es decir, revestirlos de una cubierta de metal, cuyo espesor oscila entre 5-20 μm.
Esta técnica también se conoce como electrochapado o chapado electrolítico, pues es indispensable para su implementación un medio electrolítico compuesto por los iones metálicos del metal que se desea depositar. Por lo tanto, si queremos un chapado de cobre (cobrizado), necesitaremos sales solubles de cobre, como el sulfato de cobre, disueltas en agua.
El razonamiento anterior aplica para cualquier otro metal: un chapado electrolítico de oro requerirá sales de oro, por lo general cianuros de oro, las cuales pueden llegar a ser muy tóxicas. Es así que algunos objetos, como los utensilios de comer, se pueden revestir de oro para asignarles un mayor valor y nobleza.
Pero la galvanoplastia va más allá de la estética: les confiere protección, durabilidad, conductividad, resistencia, y otras tantas propiedades a las superficies sobre la que se realiza la electrodeposición. Asimismo, permite el ahorro de los recursos naturales, pues no es necesario gastar grandes cantidades de metal para los revestimientos.
Proceso de galvanoplastia
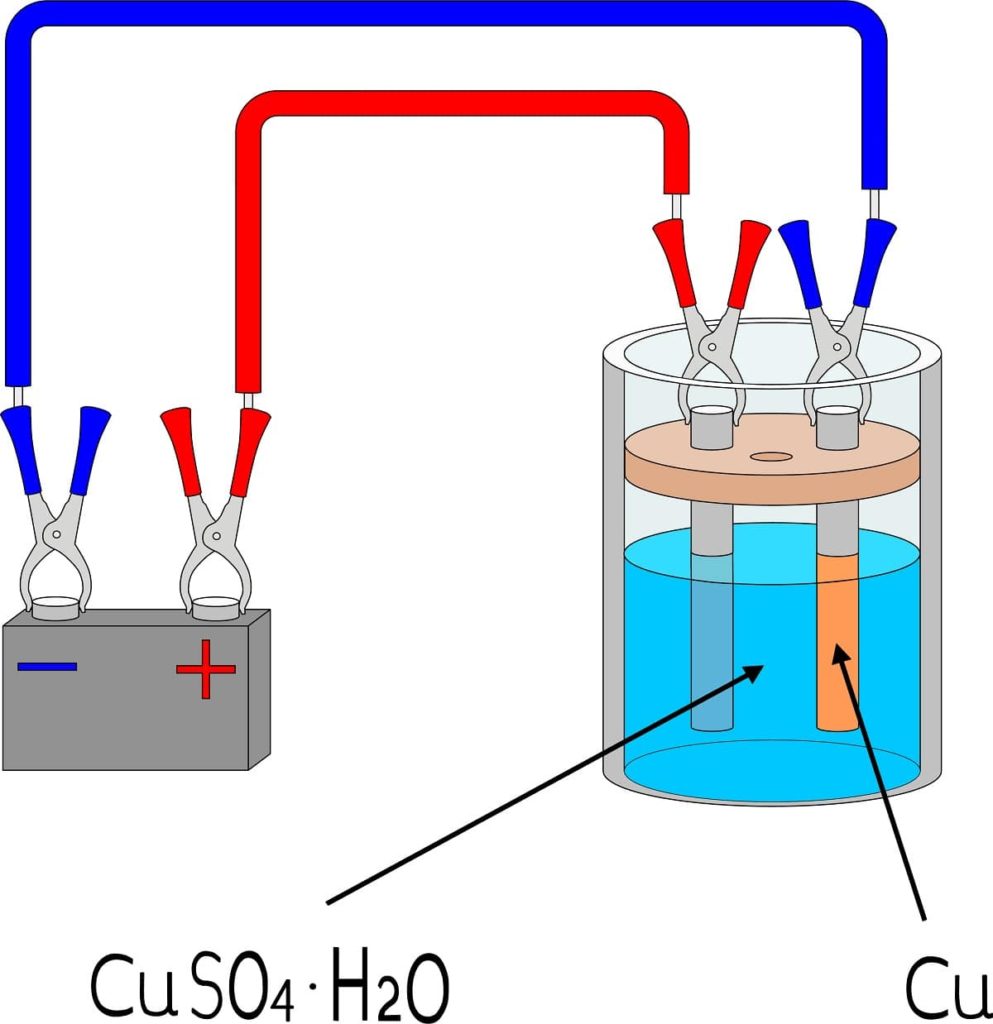
Elementos
Para electrodepositar un metal sobre una superficie se necesita de algunos elementos básicos, cuyas dimensiones y modo de montarlos variarán en función del lote de objetos a revestir.
En la imagen superior, por ejemplo, se muestra la electrodeposición de cobre a pequeña escala, reproducible en cualquier laboratorio o espacio.
Medio electrolítico
Primeramente se necesita un medio electrolítico del metal a electrodepositar. La sal sulfato de cobre, CuSO4, es muy soluble en agua, por lo que aporta iones Cu2+ que luego se reducirán a átomos Cu0. Estos átomos son los que se ensamblarán sobre la superficie receptora para dar lugar a cristales metálicos.
El medio electrolítico es indispensable para que el circuito funcione y las cargas iónicas puedan desplazarse o movilizarse hacia la región donde ocurre la electrodeposición.
Electrodos
Los electrodos son las superficies en las cuales transcurre la electrodeposición desde su base química. En términos simples hay dos electrodos: el cátodo, que es donde el metal se electrodeposita; y el ánodo, que es donde tiene lugar una reacción química que dona electrones a los iones metálicos que revestirán el cátodo.
Es decir, el cátodo viene a ser la pieza que se desea revestir de metal. Mientras, el ánodo es cualquier superficie sobre la que una especie se oxida y dona sus electrones hacia el cátodo. Muchas veces el ánodo está hecho del mismo metal que está disuelto en el medio electrolítico. Si en el medio hay cobre iónico, en este caso el ánodo será de cobre metálico.
Circuito externo
El circuito externo viene a ser una batería que aporta los electrones iniciales que promueven la electrodeposición. Su presencia significa que la reacción no es espontánea: se necesita electricidad para generar un cambio químico, el cual es la reducción de los iones metálicos disueltos.
Limpieza de los electrodos
La pieza que se va a revestir debe estar completamente limpia. De lo contrario, el chapado o el revestimiento serán defectuosos.
Para ello, hay que asegurarse que su superficie sea enteramente hidrofílica, es decir, que no posea grasa ni ningún tipo de suciedad. Una manera de asegurar esto, tras el lavado químico, es mojar la pieza con agua, y si se observa la formación de gotas de agua o una caída no uniforme del líquido, significa que el electrodo no está limpio todavía.
Reacciones y sentido de los electrones
La galvanoplastia es una reacción redox. Por lo tanto: una especie debe reducirse, mientras la otra oxidarse, o viceversa. En el cobrizado, tenemos un ánodo hecho de cobre, y un cátodo hecho de un metal Me (hierro, cinc, estaño, etc.).
Cuando encendemos la batería, de su interior fluirán electrones hacia el cátodo, el cual comienza a cargarse negativamente.
La carga negativa del cátodo atrae los cationes Cu2+ del medio electrolítico, teniendo lugar la reducción:
Cu2+(ac) + 2e– → Cu(s)
La batería necesita recuperar los electrones donados, y asimismo deben reponerse los iones Cu2+ reducidos para mantener la neutralidad del medio electrolítico. Es aquí cuando el ánodo entra en función: los átomos de cobre se oxidan:
Cu(s) → Cu2+(ac) + 2e–
Y los electrones liberados se dirigen devuelta hacia la batería, la cual a su vez los moviliza hacia el cátodo para que prosiga la electrodeposición.
El ánodo va ganando carga positiva, la cual atrae los iones SO42- del medio electrolítico (ver imagen una vez más).
Es decir, las reacciones que ocurren es la reducción y oxidación del cobre, el metal que se electrodeposita:
Cu2+(ac) + 2e– → Cu(s)
Cu(s) → Cu2+(ac) + 2e–
El ánodo, de cobre, va perdiendo masa mientras el cátodo, de otro metal, se reviste de una fina capa cobriza.
Ejemplos de galvanoplastia
Plateado
Los metales se pueden “electroplatear”, que es revestirlos electrolíticamente de una capa de plata. Esto es especialmente beneficioso en componentes electrónicos que deben conducir la electricidad. La plata se puede electrodepositar sobre el acero, el cobre, el níquel y otros metales.
Estañado
El estañado es la electrodeposición del estaño. Resulta de gran utilidad en la producción de latas de hierro, las cuales se revisten de estaño para volverlas resistentes a la corrosión, y así no dañar los alimentos o productos que almacenen.
Latonado o bronceado
Aunque un poco más elaborado, el latón y el bronce también pueden electrodepositarse sobre algunos metales para mejorar su apariencia.
Zincado
La galvanoplastia del zinc o el zincado (no confundir con el galvanizado térmico) se utiliza mayormente para conceder al hierro resistencia a la corrosión y superficies más brillantes y atractivas. Es así que su función es estética y a la vez funcional, y se le encuentra en partes de carrocería como los rines.
Plásticos metálicos
Los plásticos, previamente tratados para que posean una superficie conductora, pueden también revestirse de metal, que es como si se les adhirieran una lámina de papel aluminio.
Aplicaciones de la galvanoplastia
Las aplicaciones de la galvanoplastia o electrodeposición pueden dividirse en funcionales o estéticas.
Funcionales

Revestir una pieza u objeto es dotar su superficie con propiedades que por sí sola carece. Por ejemplo, la electrodeposición de cobre u oro vuelve conductoras las piezas que revisten, por lo que es ideal en los circuitos electrónicos para aprovechar las propiedades de estos metales, sin la necesidad de gastar toneladas de oro en la fabricación de piezas enteras y macizas.
El oro, por otra parte, protege a las superficies del calor y la radiación. Es por esta razón que es muy utilizado en los satélites y en los cascos de los astronautas, pues refleja la luz del sol evitando así que lastime sus ojos, o se caliente rápidamente.
Los aceros cromados o niquelados son muy resistentes a la corrosión gracias precisamente a estas capas metálicas. Es por eso que la galvanoplastia se usa en la industria para proteger los metales sensibles a corroerse, o que se desgastan rápidamente por acciones mecánicas.
Estéticas
Los enchapados metálicos dan brillo a los objetos. El zinc, el níquel y el cromo se usan mucho para este propósito. Asimismo, el oro y la plata se electrodepositan en anillos, cadenas, brazaletes, gargantillas, pendientes, etc., y por lo tanto su galvanoplastia encuentra muchas aplicaciones en las joyerías y ornamentaciones, para realzar la imagen y el prestigio de dichas prendas.
Referencias
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2021). Electroplating. Recuperado de: en.wikipedia.org
- Chris Woodford. (28 de julio de 2020). How Electroplating Works. Recuperado de: explainthatstuff.com
- Rob Snyder. (s.f.). Nanoscale Electrodeposition. STEM Education Institute. [PDF]. Recuperado de: nanoscale.unl.edu
- Elsevier B.V. (2021). Electrodeposition. ScienceDirect. Recuperado de: sciencedirect.com
- Vaishali Mittal. (10 de diciembre de 2020). Electroplating. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Singh Davneet. (09 de junio de 2020). Different Types of Electroplating. Recuperado de: teachoo.com
- Helmenstine, Anne Marie, Ph.D. (26 de agosto de 2020). What Is Electroplating and How Does It Work? Recuperado de: thoughtco.com
