Carbonato de amonio: propiedades, estructura, usos, riesgos
¿Qué es el carbonato de amonio?
El carbonato de amonio es una sal inorgánica de nitrógeno, específicamente amoniacal, cuya fórmula química es (NH4)2CO3. Es elaborada mediante métodos de síntesis, entre los que destaca usar la sublimación de una mezcla de sulfato de amonio y carbonato de calcio: (NH4)2SO4(s) + CaCO3(s) => (NH4)2CO3(s) + CaSO4(s).
Generalmente, las sales de amonio y carbonato de calcio son calentadas en un recipiente para originar el carbonato de amonio. El método industrial que produce toneladas de esta sal consiste en hacer pasar dióxido de carbono por una columna de absorción que contiene una solución de amonio en agua, realizándose luego una destilación.
Los vapores que contienen amonio, dióxido de carbono y agua se condensan para formar los cristales de carbonato de amonio: 2NH3(g) + H2O(l) + CO2(g) → (NH4)2CO3(s). En la reacción se produce ácido carbónico, H2CO3, tras disolverse el dióxido de carbono en el agua, y es este ácido quien cede sus dos protones, H+, a dos moléculas de amoníaco.
Propiedades del carbonato de amonio

Es un sólido blanco, cristalino e incoloro, con fuertes olores y sabores amoniacales. Funde a 58 ºC descomponiéndose en amoníaco, agua y dióxido de carbono: exactamente la ecuación química anterior pero en sentido contrario.
Sin embargo, esta descomposición ocurre en dos pasos: primero se libera una molécula de NH3, produciendo bicarbonato de amonio (NH4HCO3); y segundo, si el calentamiento prosigue, se desproporciona el carbonato liberando aún más amoníaco gaseoso.
Es un sólido muy soluble en agua y menos soluble en alcoholes. Forma puentes de hidrógeno con el agua, y cuando se disuelve 5 gramos en 100 gramos de agua, genera una solución básica con un pH alrededor de 8,6.
Su alta afinidad por el agua lo hacen un sólido higroscópico (absorbe humedad), y por eso es difícil encontrarlo en su forma anhídrida. De hecho, su forma monohidratada, (NH4)2CO3·H2O), es la más común de todas y explica cómo la sal es portadora del gas amoníaco, causante del olor.
En el aire se descompone para generar bicarbonato de amonio y carbonato de amonio (NH4NH2CO2).
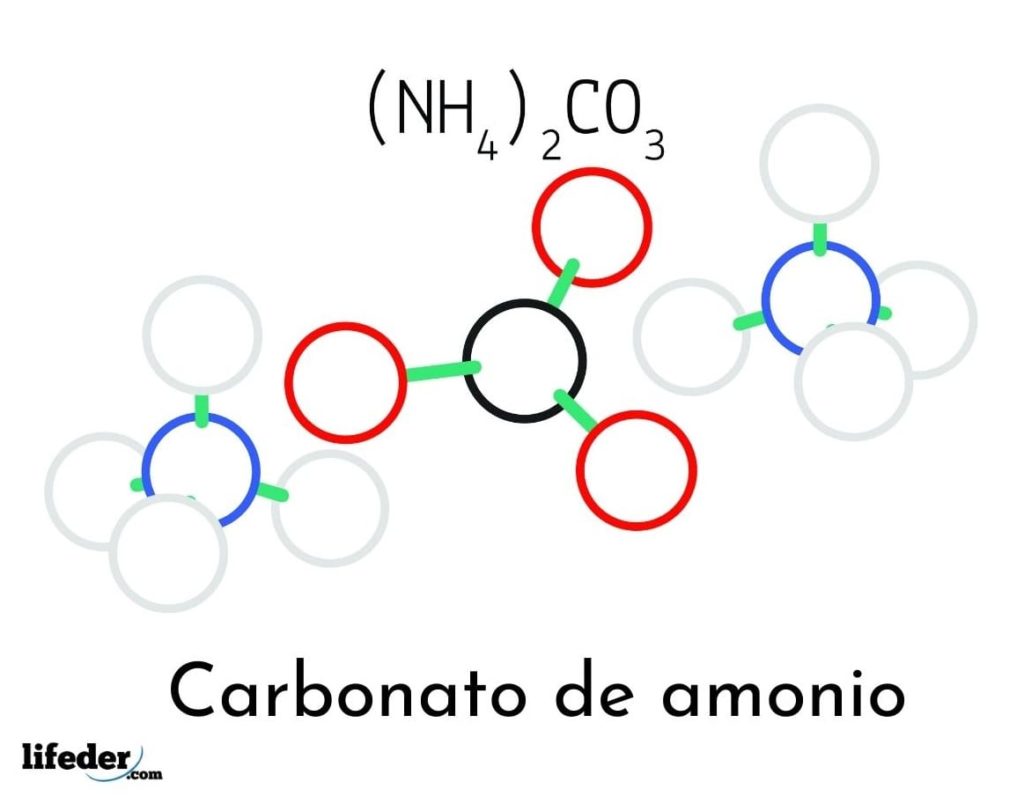
Estructura química
En la imagen superior está ilustrada la estructura química del carbonato de amonio. En el medio está el anión CO32–, el triángulo plano con el centro negro y las esferas rojas; y a sus dos lados, los cationes amonios NH4+ con geometrías tetraédricas.
La geometría del ion amonio se explica por la hibridación sp3 del átomo de nitrógeno, ordenando los átomos de hidrógenos (las esferas blancas) a su alrededor en forma de un tetraedro. Entre los tres iones se establecen interacciones por puentes de hidrógeno (H3N-H— O-CO22–).
Gracias a su geometría, un solo anión CO32– puede formar hasta tres puentes de hidrógeno; mientras que los cationes NH4+ quizás no puedan formar sus correspondientes cuatro puentes de hidrógeno a causa de las repulsiones electrostáticas entre sus cargas positivas.
El resultado de todas estas interacciones es la cristalización de un sistema ortorrómbico. ¿Por qué es tan higroscópico y soluble en agua? La respuesta está en el mismo párrafo anterior: los puentes de hidrógeno.
Son estas interacciones las responsables de la rápida absorción de agua de la sal anhídrida para formar (NH4)2CO3·H2O). Esto trae como consecuencia cambios en el arreglo espacial de los iones, y por consiguiente, en la estructura cristalina.
Curiosidades estructurales
Por muy simple que luzca el (NH4)2CO3, es tan sensible a infinidad de transformaciones que su estructura es un misterio sometido a la composición verdadera del sólido. Esta estructura también varía de acuerdo a las presiones que inciden sobre los cristales.
Algunos autores han encontrado que los iones se ordenan como cadenas coplanares unidas por puentes de hidrógeno (es decir, una cadena con una secuencia NH4+—CO32–—…) en las que probablemente las moléculas de agua sirvan como conectores a otras cadenas.
Aún más, trascendiendo el cielo terrestre, ¿cómo son estos cristales en condiciones espaciales o interestelares? ¿Cuáles son sus composiciones en términos de las estabilidades de las especies carbonatadas? Existen estudios que confirman la gran estabilidad de estos cristales atrapados en las masas de hielo planetarias y de los cometas.
Esto les permite fungir como reservas de carbono, nitrógeno e hidrógeno, los cuales, recibiendo radiaciones solares, pueden transformarse en material orgánico como los aminoácidos.
Es decir, estos helados bloques amoniacales podrían ser portadores de “la rueda que inicia la maquinaria de la vida” en el cosmos. Por estas razones es creciente su interés en el campo de la astrobiología y la bioquímica.
Usos/aplicaciones
Es usado como agente leudante, ya que al ser calentado produce dióxido de carbono y gases de amonio. El carbonato de amonio es, si se quiere, un precursor de los polvos de hornear modernos y puede usarse para hornear galletas y bizcochos planos.
Sin embargo, no es recomendable su uso para hornear tortas. Debido al espesor de las tortas, los gases de amonio quedan retenidos en el interior y producen un sabor desagradable.
Se usa como expectorante, es decir, alivia la tos al descongestionar los bronquios. Tiene acción fungicida, usándose por esta razón en la agricultura. También es un regulador de la acidez presente en alimentos y es utilizado en las síntesis orgánicas de urea en condiciones de altas presiones, y de hidantoínas.
Riesgos
El carbonato de amonio es altamente tóxico. Produce en los seres humanos una irritación aguda de la cavidad oral al ponerse en contacto.
Además, si es ingerido provoca una irritación gástrica. Una acción semejante es observada en los ojos expuestos al carbonato de amonio.
La inhalación de los gases de la descomposición de la sal, pueden irritar la nariz, la garganta y los pulmones, causantes de tos y dificultad respiratoria.
La exposición aguda de perros en ayunas al carbonato de amonio a una dosis de 40 mg/kg de peso, provoca en ellos vómito y diarrea. Las dosis más elevadas del carbonato de amonio (200 mg/kg de peso) suelen ser letales. Un daño cardíaco es señalado como el causante de la muerte.
Si se calienta a muy altas temperaturas y en un aire enriquecido con oxígeno, desprende gases tóxicos de NO2.
Referencias
- PubChem. (2018). Ammonium Carbonate. Recuperado el 25 de marzo de 2018, de PubChem: pubchem.ncbi.nlm.nih.gov
- Organic Chemistry Portal. ((2009-2018)). Bucherer-Bergs Reaction. Recuperado el 25 de marzo de 2018, de Organic Chemistry Portal: www.organic-chemistry.org
- Wikipedia. (2018). Ammonium carbonate. Recuperado el 25 de marzo de 2018, de Wikipedia: en.wikipedia.org
- The Chemical Company. (2018). The Chemical Company. Recuperado el 25 de marzo de 2018, de The Chemical Company: thechemco.com
