Ley de Avogadro: qué es, fórmula, condiciones, importancia, ejemplos
¿Qué es la ley de Avogadro?
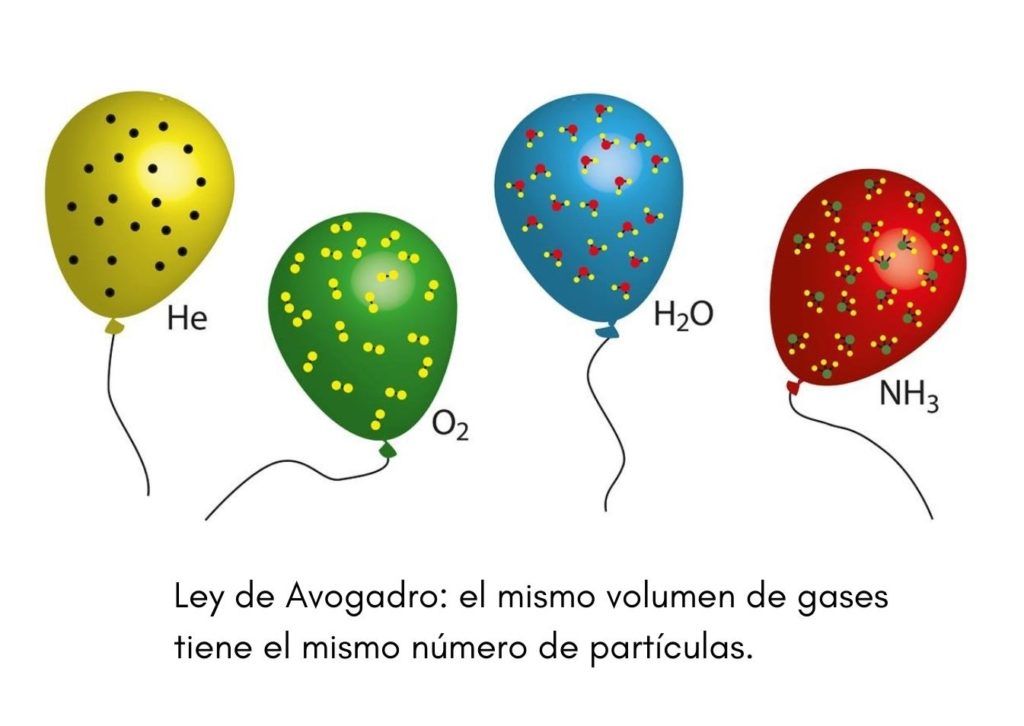
La ley de Avogadro, también llamada principio de Avogadro, es una ley que se aplica a los gases ideales y que fue enunciada por un científico del siglo XIX llamado Amadeo Avogadro. Esta ley establece que dos volúmenes iguales de gases diferentes que se encuentren en las mismas condiciones de temperatura y presión, contendrán el mismo número de partículas gaseosas.
Esto quiere decir que, si tenemos dos globos, uno lleno con helio y el otro con oxígeno, y ambos globos tienen el mismo volumen, la misma presión y la misma temperatura, entonces habrá el mismo número de átomos de helio gaseoso en el primer globo que de moléculas de oxígeno en el segundo.
Fórmula de la ley de Avogadro
Otra manera de enunciar la ley de Avogadro es diciendo que, si se mantienen la presión y la temperatura constantes, el volumen de un gas será proporcional al número de moles. Esto se representa en forma matemática como:
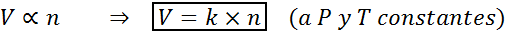
Esta fórmula se puede reordenar a V/n=k, es decir, que la relación entre el volumen y el número de moles permanece constante siempre que P y T sean constantes.
Así que, si introducimos o retiramos cierta cantidad de gas de un recipiente manteniendo P y T constantes, el volumen cambiará y el estado inicial y final estarán relacionados por medio de la siguiente ecuación:
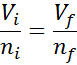
Condiciones bajo las que se cumple la ley de Avogadro
Esta ley se aplica de manera exacta a los gases ideales. Estos son gases formados por partículas puntuales (que no ocupan un volumen en el espacio) que no interactúan entre sí de ninguna manera.
Como su nombre lo indica, este tipo de gases no existe en la realidad sino en nuestra imaginación. Son una “idea” simplificada de lo que creemos que es un gas. Sin embargo, existen algunas condiciones bajo las cuales un gas real, como por ejemplo el aire, se comporta de manera ideal: a muy bajas presiones y a muy altas temperaturas.
Las bajas presiones hacen que el volumen que ocupan las partículas de un gas sea despreciable en comparación con el tamaño del recipiente, mientras que las altas temperaturas hacen que las partículas se muevan tan rápido que no tienen tiempo de interactuar cuando se cruzan unas con otras.
Bajo estas condiciones, la mayoría de los gases cumple la ley de Avogadro con buena exactitud.
Importancia de la ley de Avogadro
Uno de los aportes más importantes de la ley de Avogadro fue que permitió demostrar la existencia de gases elementales formados por más de un átomo tal como el O2 o el H2. Esto contribuyó al avance de la teoría atómica.
Además, la ley de Avogadro complementa a las leyes de los gases de Boyle, Charles y Gay-Lussac, y al combinarla con estas tres leyes, la ley de Avogadro permite derivar la ley de los gases ideales, una de las leyes más importantes en la química.
Por otro lado, la ley de Avogadro también permite establecer relaciones entre los pesos moleculares de distintos gases, ya que implica que la masa de volúmenes iguales de gases diferentes medidos a la misma temperatura y presión, es proporcional a la masa de cada partícula de cada gas.
Así que con solo pesar muestras de dos gases que ocupen volúmenes iguales a la misma temperatura y presión, se puede obtener la relación entre sus masas molares.
Ejemplos de la ley de Avogadro en la vida cotidiana
Los globos de fiesta
Todos alguna vez hemos visto a un payaso en una fiesta infantil inflando globos de helio para repartirlos entre los niños. Estos globos se encuentran a aproximadamente la misma temperatura. Si dos globos de fiesta se llenan a la misma presión y ambos tienen el mismo tamaño, la ley de Avogadro asegura que ambos globos tendrán el mismo número de moles de helio.
Por otro lado, si uno de los globos es más grande que el otro, tendrá un volumen mayor y, según la ley de Avogadro, tendrá una mayor cantidad de partículas de helio en su interior.
Las llantas de un automóvil
Sin importar con qué gas se llenen, las llantas de los lados opuestos de un automóvil siempre se llenan hasta la misma presión final de alrededor de 32 psi.
Además, siempre se procura que ambos cauchos sean iguales, por lo que tendrán el mismo volumen. Así, según el principio de Avogadro, podemos decir que ambas llantas contendrán el mismo número de partículas gaseosas.
Una jeringa llena de aire
Supongamos que tenemos una jeringa abierta y llena de 50 cm3 de aire. Como está abierta, el interior de la jeringa y el exterior (los alrededores) están a la misma temperatura y presión.
Ahora supongamos que presionamos el émbolo de la jeringa y la desplazamos hasta que se lean 10 cm3. Como la jeringa está destapada, el aire se escapa por la punta a medida que el émbolo se mueve, por lo que el número de partículas de aire dentro de la jeringa disminuye junto con el volumen.
Como ni la presión ni la temperatura están cambiando, se puede aplicar la ley de Avogadro para relacionar el volumen final con la cantidad de partículas de aire que permanecen dentro de la jeringa. Esta relación es:
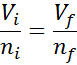
Reordenando esta ecuación, obtenemos que:
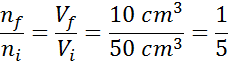
Este resultado significa que, si reducimos el volumen dentro de la jeringa a la quinta parte manteniendo P y T constantes, entonces el número de moles o de partículas presentes en el interior al final del proceso será también la quinta parte de lo que había originalmente.
