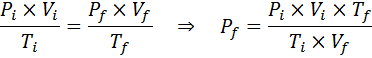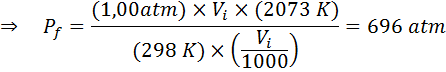Ley general de los gases: qué es, fórmula, ejemplos de aplicación
¿Qué es la ley general de los gases?
La ley general de los gases, a veces también llamada ley combinada de los gases, es la combinación de las leyes de Boyle, de Charles y de Gay-Lussac. Es una ley que describe la relación entre la presión, la temperatura y el volumen de una cantidad fija de un gas ideal.
El enunciado de esta ley dice:
“Si se mantiene constante el número de moles de un gas, la relación entre el producto Presión-Volumen y la temperatura, permanece constante.”
En forma matemática, la ley general de los gases se expresa así:
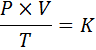
donde P representa la presión del gas, V su volumen, T su temperatura absoluta, y K es una constante de proporcionalidad, cuyo valor depende tanto de la cantidad de gas presente como de las unidades en las que se expresen las demás variables.
Formas alternativas de la ley general de los gases
Como ley de proporcionalidad
Una forma alterna de enunciar la ley general de los gases es en forma de una ley de proporcionalidad:
“Para cualquier cantidad fija de un gas, el producto de su presión y su volumen es directamente proporcional a la temperatura”.
Esto quiere decir que:
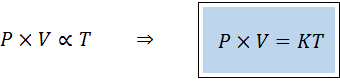
Esto es equivalente a multiplicar ambos miembros de la primera ecuación por la temperatura.
Relación entre el estado inicial y final
Al igual que las leyes de Boyle, Charles y Gay-Lussac, la ley general de los gases se puede expresar como una relación entre el estado inicial y el estado final de un gas que sufre un cambio de estado.
A diferencia de las leyes anteriores, no es necesario que ninguna de las tres variables permanezca constante, solo el número de moles. Es decir que la relación PxV/T será la misma en el estado inicial, i, y en el estado final, f. En otras palabras, la ley general de los gases también se puede expresar matemáticamente como:
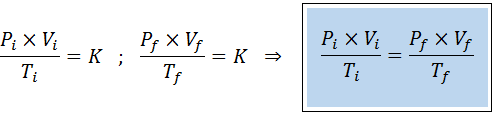
Derivación de la fórmula de la ley general de los gases
Como se mencionó anteriormente, la ley general de los gases proviene de la combinación de las leyes de Boyle, Charles y Gay-Lussac. Estas leyes se presentan a continuación:
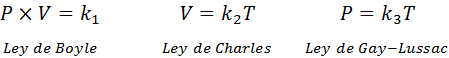
Si de cada una de estas leyes despejamos la constante k, y luego las multiplicamos entre sí, obtenemos:
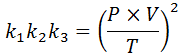
Ahora, tomando la raíz cuadrada en ambos miembros se obtiene la ley general de los gases:
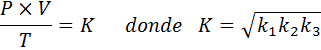
La ley general de los gases vs. la ley de los gases ideales
No se debe confundir la ley general de los gases con la ley de los gases ideales. A pesar de tratarse de dos leyes muy similares y además muy relacionadas, la ley general de los gases combina solo las leyes de Boyle, Charles y Gay-Lussac.
Por su parte, la ley de los gases ideales le añade el principio de Avogadro, según el cual “volúmenes iguales de diferentes gases medidos bajo las mismas condiciones de temperatura y presión, contienen el mismo número de partículas”.
Como consecuencia, además de relacionar entre sí la temperatura, el volumen y la presión, la ley de los gases ideales también permite relacionar estas variables con el número de partículas o los moles de un gas, por lo que representa la ecuación de estado de los gases ideales.
En las siguientes ecuaciones se puede observar más fácilmente la diferencia entre estas dos leyes:

Nótese que la principal diferencia entre ambas leyes, es que la ley de los gases ideales incluye n, que representa el número de moles, y además en lugar de la constante K, tiene la constante R que es la constante de los gases ideales.
Podríamos decir que la ley de los gases ideales es más general que la ley general de los gases, ya que se puede aplicar para cualquier cantidad de un gas bajo cualquier set de condiciones de presión, temperatura y volumen. En cambio, la aplicación de la ley general de los gases exige que la cantidad del gas permanezca constante.
Ejemplos de la aplicación de la ley general de los gases
A continuación, se presentan algunos ejemplos de problemas típicos en los cuales se puede aplicar la ley general de los gases:
Ejemplo 1: Una burbuja de aire bajo el agua
Supongamos que un buzo que se encuentra a una profundidad de 20 m bajo el agua donde la presión es de 3,00 atm y la temperatura es de 15 °C libera una bocanada de aire y una de las burbujas tiene un volumen inicial de 100 cm3.
Determine el volumen de la burbuja de aire al llegar a la superficie que se encuentra en condiciones estándar de temperatura y presión, asumiendo que la cantidad de aire dentro de la burbuja no cambia a medida que sube.
Solución
En primer lugar, debemos extraer todos los datos del enunciado. Se entiende que hay dos estados diferentes para el gas, uno inicial y otro final, por lo que separamos los datos en dos grupos. También es necesario convertir las temperaturas a temperatura absoluta:

Como el problema especifica que no hay cambio en la cantidad del gas (el aire) entonces podemos aplicar la ley general de los gases, a partir de la cual podemos despejar el volumen final:
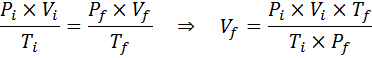
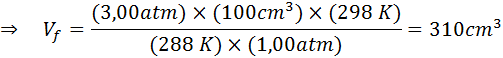
Por lo tanto, la burbuja de aire alcanza un volumen de 310 cm3 al llegar a la superficie.
Ejemplo 2: Alta presión
¿A cuánto aumentará la presión de una muestra de un gas ideal que se encuentra a una temperatura ambiente de 25 °C y una presión de 1,00 atm y se comprime a la milésima parte de su volumen a la vez que se calienta hasta 1800 °C en un recipiente sellado?
Solución
Al igual que antes, comenzamos extrayendo los datos:

Como dice que el proceso se lleva a cabo en un recipiente sellado, entonces la cantidad del gas no cambia, así que se puede aplicar la ley general de los gases: