Oxihemoglobina: características, estructura y curva de unión
Oxihemoglobina es el nombre que recibe la hemoglobina cuando se une al oxígeno. La hemoglobina es una proteína que se encuentra dentro de los glóbulos rojos y cuya función principal es la de transportar oxígeno desde los pulmones hasta los tejidos.
Los primeros seres vivos eran unicelulares y vivían en un ambiente líquido del que se nutrían y al que eliminaban sus desechos, al igual que algunos de los organismos que existen en la actualidad. Bajo dichas condiciones, estos procesos se logran por mecanismos de difusión simple, ya que la pared celular está en contacto íntimo con el medio que la abastece.
El desarrollo de organismos pluricelulares cada vez más complejos implicó que las células internas se alejaran considerablemente del medio ambiente, por lo que los mecanismos de difusión como única fuente de abastecimiento se hicieron insuficientes.
Así pues, se desarrollaron sistemas especializados para obtener los nutrientes y los gases como el sistema digestivo y el sistema respiratorio, así como mecanismos de transporte para acercar esos nutrientes y gases a la célula: el sistema cardiovascular.
Para producir energía en forma de moléculas de ATP, las células necesitan oxígeno. En vista de que el ATP no puede almacenarse, debe ser sintetizado constantemente, lo que significa una demanda permanente de oxígeno por parte de las células.
La hemoglobina surgió, evolutivamente hablando, como un transportador de gases que “resolvió” el problema del transporte de oxígeno desde el medio ambiente hasta la célula.
Índice del artículo
Para hablar de las características y la estructura de la oxihemoglobina es necesario hacer referencia a la hemoglobina, puesto que la oxihemoglobina no es más que hemoglobina unida a oxígeno. Por lo tanto, en adelante, se describirán las características conjuntas de la molécula en presencia o no del gas en cuestión.
La hemoglobina es necesaria para transportar el oxígeno hacia los tejidos en la cantidad y la velocidad que estos ameritan, en vista de que el oxígeno tiene tan poca solubilidad en la sangre que su transporte por difusión sería insuficiente para abastecer las necesidades tisulares.
La hemoglobina es una proteína tetramérica (que posee cuatro subunidades), tiene forma esférica y una masa molecular de 64 kDa.
Sus cuatro subunidades constituyen una sola unidad funcional, en donde cada una influye recíprocamente sobre la otra. Cada subunidad se compone de una cadena polipeptídica, la globina, y de un grupo prostético, el grupo hemo o “hem”, que actúa como cofactor y que no está formado por aminoácidos; es decir, no es de naturaleza proteica.
La globina se encuentra de dos formas: la globina alfa y la globina beta. El tetrámero de la hemoglobina consta de un par de cadenas de globina alfa (de 141 aminoácidos) y un par de cadenas de globina beta (de 146 aminoácidos).
Cada una de las cuatro cadenas polipeptídicas están unidas a un grupo hemo, que tiene en el centro un átomo de hierro en estado ferroso (Fe2+).
El grupo hemo es un anillo porfirínico que está formado por cuatro anillos pirrólicos (compuestos aromáticos heterocíclicos con la fórmula C4H5N) unidos mediante puentes metilo. El hierro en estado ferroso que se encuentra en el centro está sujeto a la estructura a través de enlaces de nitrógeno coordinados.
Cada grupo hemo es capaz de unirse a una molécula de oxígeno, por lo que cada molécula de hemoglobina solo puede unir 4 moléculas del gas.
El cuerpo humano contiene aproximadamente 2,5 x 1013 eritrocitos, que son las células sanguíneas que producen y transportan la hemoglobina. Cada eritrocito posee unos 280 millones de moléculas de hemoglobina y podrá transportar, entonces, más de 1000 millones de moléculas de oxígeno.
La oxihemoglobina se forma tras la unión de un átomo de oxígeno a cada átomo de hierro en estado ferroso que encuentra en cada grupo hemo de la molécula de hemoglobina.
El término oxihemoglobina se refiere, entonces, a una hemoglobina oxigenada y no químicamente oxidada, ya que esta no pierde un electrón al combinarse con el oxígeno y el hierro se mantiene en estado ferroso.
La oxigenación produce un cambio en la estructura cuaternaria de la molécula, es decir, un cambio de conformación que se puede transmitir de las cadenas de globina al grupo hemo y viceversa.
La hemoglobina puede, como máximo, unir cuatro moléculas de oxígeno en su estructura. Si el volumen molar de los gases ideales es de 22.4 L/mol, un mol de hemoglobina (64.500g) se unirá con 89.6 litros de oxígeno (4 moles de O2 x 22.4 L/mol).
Entonces, cada gramo de hemoglobina debe unirse a 1.39 ml de O2 para estar 100% saturado (89.6L/64500g x (1000ml/L)).
En la práctica, los análisis sanguíneos arrojan resultados ligeramente inferiores, puesto que existen pequeñas cantidades de metahemoglobina (hemoglobina oxidada) y carboxihemoglobina (hemoglobina + monóxido de carbono (CO)) que no pueden unir oxígeno.
Tomando en cuenta esto, la regla de “Hüfner” establece que, en la sangre, 1g de hemoglobina tiene una capacidad máxima de unir oxígeno de 1.34ml.
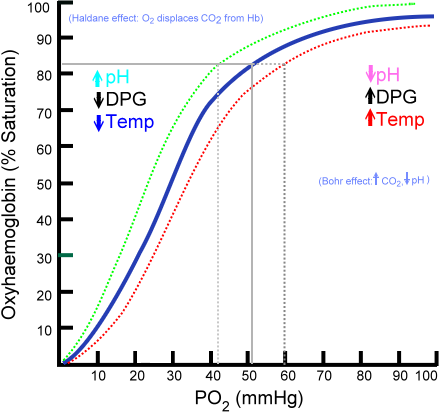
La cantidad de moléculas de oxígeno que se pueden unir a una molécula de hemoglobina depende de la presión parcial de oxígeno o PO2. En ausencia de oxígeno la hemoglobina está desoxigenada, pero a medida que aumenta la PO2, aumenta el número de oxígenos que se unen a la hemoglobina.
El proceso de unión de oxígeno a la hemoglobina dependiente de la presión parcial de oxígeno. Cuando se grafica, el resultado se denomina “curva de la oxihemoglobina” y tiene una forma característica de ‘S’ o sigmoidea.
Dependiendo de la PO2, la hemoglobina estará en menor o mayor capacidad de “liberar” o “entregar” el oxígeno que transporta, así como de cargarse con este.
Por ejemplo, en la región entre 10 y 60 mmHg de presión se obtiene la parte con más pendiente de la curva. En esta condición la hemoglobina puede ceder fácilmente grandes cantidades de O2. Esta es la condición que se consigue en los tejidos.
Cuando la PO2 está entre los 90 y los 100 mmHg (12 a 13 kPa), la hemoglobina está casi 100% saturada con O2; y cuando la PO2 arterial es de 60 mmHg (8 kPa) la saturación con O2 aún es tan elevada como 90%.
En los pulmones estas son las condiciones que predominan (presión entre 60 y 100 mmHg), y es esto lo que permite que las moléculas de hemoglobina presentes en los eritrocitos se carguen con oxígeno.
Esta forma sigmoidea que dibuja la curva de la oxihemoglobina asegura que esta proteína se comporte como un excelente cargador a nivel pulmonar, un transportador muy eficiente en la sangre arterial y un excelente donador de O2 en los tejidos, en proporción a la tasa metabólica local, es decir, a la demanda.
- Fox, S. I. (2006). Human Physiology 9th Edition (pp. 501-502). McGraw-Hill press, New York, USA.
- Murray, R. K., Granner, D. K., Mayes, P. A., & Rodwell, V. W. (2014). Harper’s illustrated biochemistry. McGraw-Hill.
- Rawn, J. D. (1998). Biochemistry (1989). Burlington, North Carolina: Neil Patterson Publishers (c) N. Lalioti, CP Raptopoulou, A. Terzis, A. Panagiotopoulos, SP Perlepes, E. Manessi-Zoupa, J. Chem. Soc. Dalton Trans, 1327.
- Robert M. Berne, Matthew N. Levy. (2001) Fisiología. (3er Ed.) Ediciones Harcourt, S.A.
- West, J. B. (1991). Physiological basis of medical practice. Williams & Wilkins
