Fuerzas intermoleculares: concepto, tipos y ejemplos
¿Qué son las fuerzas intermoleculares?
Las fuerzas intermoleculares son un conjunto de interacciones que tienen lugar entre las moléculas, sean de un mismo compuesto químico o no, y que las mantienen unidas. Gracias a estas fuerzas las moléculas logran agruparse y definir un sólido, líquido o gas; es decir, son responsables de las propiedades físicas de las sustancias.
Las fuerzas intermoleculares pueden ser de dos tipos: electrostáticas o de Van der Waals. Las electrostáticas son todas aquellas donde tenemos iones, los cuales son átomos o moléculas cargados eléctricamente (+ o -). Mientras, las de Van der Waals involucran átomos o moléculas neutros, que por fluctuaciones en su distribución electrónica se polarizan y se atraen o repelen entre sí.
Las fuerzas intermoleculares pueden compararse a la unión existente entre distintas piezas de Legos. Dependiendo de sus formas y orientaciones, sus uniones se vuelven más débiles o fuertes, al igual que cambian el diseño y las dimensiones finales de la construcción.
Cuanto más fuerte sean estas fuerzas, más difícil será separar las piezas de Legos o, en el caso de la química, las moléculas. Esto también significa que habrá mayor compactación y que, por lo tanto, las moléculas definirán líquidos más viscosos, gases más pesados o sólidos más densos.
Otras propiedades físicas como los puntos de fusión y ebullición, la volatilidad, la textura, etc., también son reflejos macroscópicos de las fuerzas intermoleculares que gobiernan entre las moléculas o iones de un compuesto o de unas mezclas. Por ejemplo: las fuerzas intermoleculares de los gases son muy débiles en comparación a las de una piedra.
Entender las fuerzas intermoleculares es esencial para describir muchos de los conceptos químicos, físicos y biológicos.
Fuerzas electrostáticas
Ión-ión
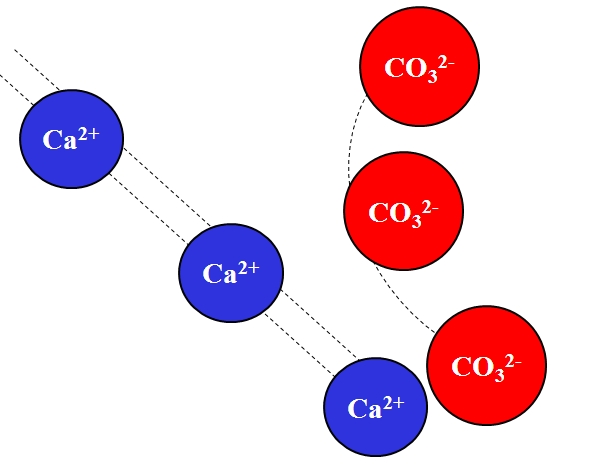
Los iones de cargas opuestas se atraen con mucha fuerza, la cual obedece la ley de Coulomb, y decrece rápidamente cuanto más se alejen los iones.
Por ejemplo, el ion Ca2+ es de carga positiva, un catión, mientras el CO32- es un ion de carga negativa, un anión. Al ser sus cargas opuestas, Ca2+ y CO32- se atraen entre sí, evidenciándose que mientras más cercas estén, más juntos permanecerán.
Por el contrario, iones con la misma carga, ya sean positivos o negativos, se repelen con la misma fuerza pero en sentido opuesto. Así, el Ca2+ repelería a iones como Na+, Mg2+, K+, etc., a menos que haya otros aniones que disminuyan la repulsión.
De todas las fuerzas intermoleculares, las del tipo ión-ión es la más simple; pero al mismo tiempo, la más fuerte de todas. Se necesita de mucha energía o calor para separar los iones.
Ión-dipolo
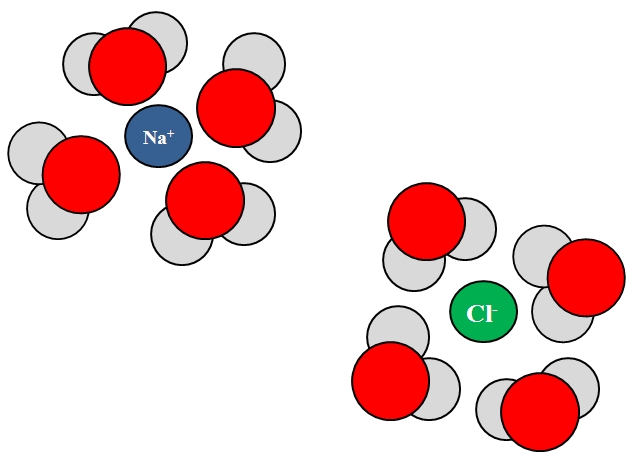
Los iones también pueden interactuar con átomos o moléculas neutras, tales como las del agua. Esto es especialmente cierto cuando se trata de las moléculas de un solvente, el cual solvata, es decir, rodea a los iones en el seno de su líquido.
Por ejemplo, el cloruro de sodio, NaCl, se compone de iones Na+ y Cl–. Cuando sus cristales se echan al agua, las moléculas del agua, H2O o HOH, hidratan o rodean a los iones del NaCl; pero el modo en que lo hacen varía dependiendo del ion en cuestión.
Así, vemos en la imagen superior que el ion Na+ es hidratado por los átomos de oxígeno del H2O. Mientras, el ion Cl– es hidratado por los átomos de hidrógeno.
¿Por qué? Porque el agua es una sustancia polar, lo que significa que posee un dipolo: un polo con carga parcial positiva, y otro con carga parcial negativa.
El átomo de oxígeno, por ser más electronegativo, atrae los electrones hacia sí, localizándose por lo tanto los electrones con mayor frecuencia en torno a ese átomo; cosa que no sucede igual con los átomos de hidrógeno, menos electronegativos. El oxígeno, por ser más negativo, se orienta hacia el Na+; mientras que los hidrógenos, por ser más positivos, se orientan hacia el Cl–, ya que cargas opuestas se atraen.
Ión-dipolo inducido
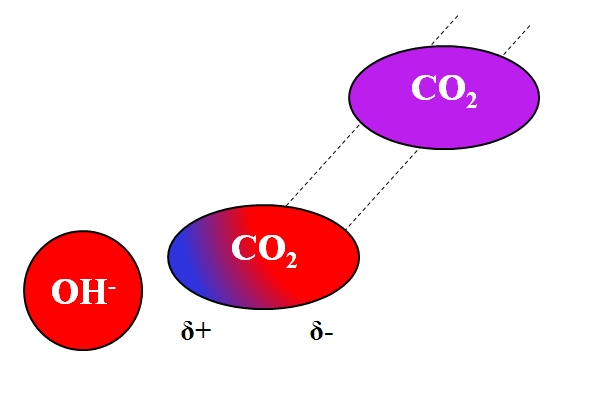
No solo las moléculas polares o con dipolos pueden interaccionar con los iones. Para los átomos o moléculas neutras, aunque no tengan dipolos, la distribución de sus electrones es susceptible a los efectos inductivos de iones cercanos; es decir, los iones ocasionan una momentánea y breve polarización, la suficiente para que haya una notable interacción.
Supóngase por ejemplo la interacción entre el ion OH– y la molécula de CO2. El CO2 es un compuesto neutro, cuya molécula (en morado) carece de dipolo. Sin embargo, a medida que se aproxima al OH–, la carga negativa de este repele a los electrones de los átomos de oxígeno del CO2.
Cuanto más cerca estén el OH– y el CO2, más fuerte será la repulsión. En consecuencia, comienza a establecerse un dipolo inducido por el OH– sobre el CO2. Aparece entonces un polo positivo δ+ debido a que los electrones, repelidos, “emigran” hacia el otro extremo de la molécula.
Así, el OH– y el CO2 permanecen lo suficiente juntos para que reaccionen entre sí. Esta es la razón por la que el CO2 es particularmente soluble en soluciones alcalinas.
Fuerzas de Van der Waals
Las fuerzas de Van der Waals, en principio, se refiere solamente a las que existen entre átomos o moléculas neutros, sin cargas iónicas.
Dipolo-dipolo (Keesom)
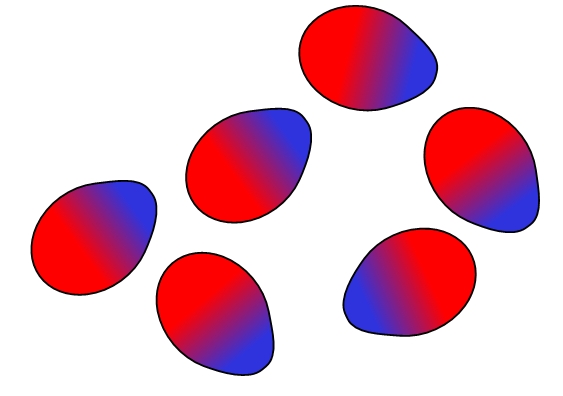
Cargas opuestas se atraen, cargas iguales se repelen. Lo mismo es cierto para los dipolos: polos opuestos (δ+ y δ-) se atraen, mientras que polos iguales se repelen. Los polos positivos o δ+ están representados arriba con el color azul, en cambio que los polos negativos o δ-, están representados con el color rojo.
Nótese cómo las moléculas de arriba se orientan y ordenan de tal modo que los polos opuestos se encuentren, alejando en el proceso a los polos iguales. Este ordenamiento es lo que se conoce como las interacciones o fuerzas dipolo-dipolo (fuerzas de Keesom), y son las fuerzas intermoleculares más importantes entre las moléculas polares.
Por ejemplo, las moléculas de H2O, HCl, HF, CO, entre otras, se ordenan de modos similares. Cuanto más polares sean, más fuertes serán sus fuerzas dipolo-dipolo; y por lo tanto, más difícil será separar sus moléculas.
El HF es más polar que el HCl, por lo que el punto de ebullición del HF es superior (19.5 ºC) al del HCl (-85.05 ºC). Resulta increíble el efecto que tienen las fuerzas intermoleculares sobre las propiedades físicas. La más pequeña variación, y la sustancia se comportará totalmente diferente de lo esperado.
Dipolo-dipolo inducido (Debye)
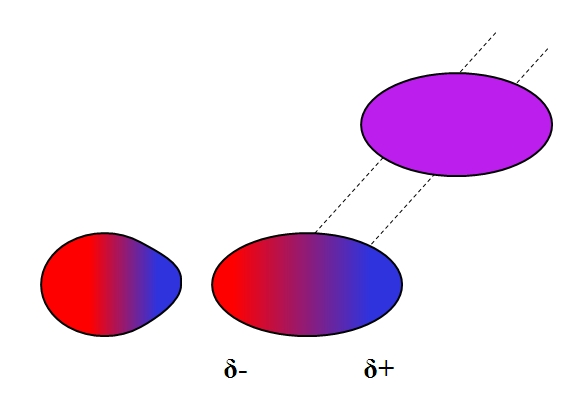
Los dipolos, al igual que los iones, también pueden fluctuar o afectar la distribución electrónica de átomos o moléculas neutras. Así vemos, en la imagen superior, que un dipolo de repente polariza a una molécula neutra. Se dice por lo tanto que se trata de una fuerza dipolo-dipolo inducido, pues el segundo dipolo es momentáneo, no permanente.
Por ejemplo, el agua es capaz de disolver una pequeña cantidad de O2, pero la suficiente para que la fauna marina respire. Si el H2O no pudiera inducir un dipolo en el O2, todo el oxígeno de los mares escaparía a la superficie, pues no habría interacciones entre ambas moléculas.
Dipolo instantáneo-dipolo inducido (London)
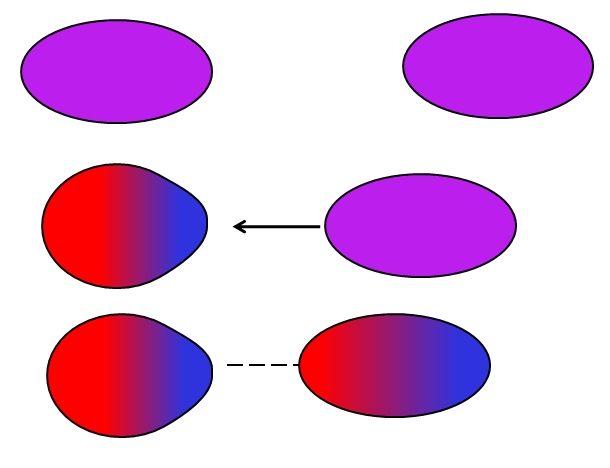
Los átomos o moléculas neutras no necesitan de iones o dipolos vecinos para sufrir por sí solas fluctuaciones en la distribución de sus cargas internas. Los electrones no están quietos, sino que se mueven por toda la molécula. En algún momento, tendrá lugar un dipolo instantáneo, el cual si está muy cerca de una molécula o átomo neutro, inducirá un dipolo en ellos (ver arriba).
Cuanto más grandes y asimétricas sean estas moléculas, más probable será que ocurran los dipolos instantáneos. Es por eso que los compuestos de mayores masas atómicas presentan fuerzas dipolo instantáneo-dipolo inducido más intensas. Este tipo de fuerzas de Van der Waals es mejor conocida como fuerzas de London.
Por ejemplo, los gases nobles (He, Ne, Ar, etc.) se mantienen unidos gracias a las fuerzas de London, al igual que los gases del aire (O2, N2, CO2, etc.). Asimismo, esta fuerza es la más predominante entre hidrocarburos como el metano, CH4, y el propano, CH3CH2CH3.
Fuerzas hidrofóbicas
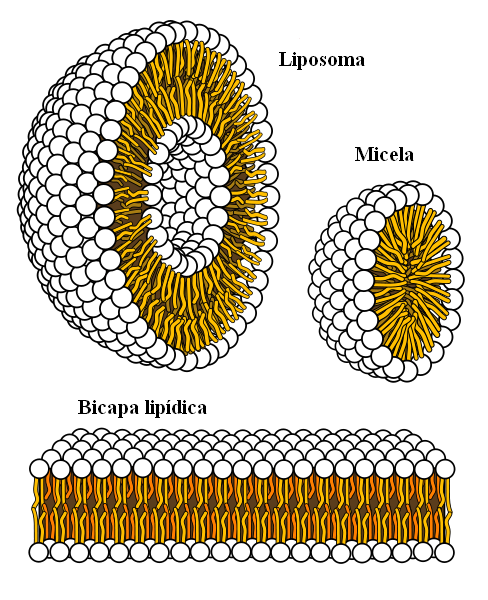
Finalmente, tenemos las fuerzas hidrofóbicas, las cuales son un resultado especial de las fuerzas de London y de las repulsiones entre sustancias con diferentes polaridades. Las grasas son poco afines al agua, por lo que es insoluble en esta.
Las moléculas de la grasa buscan agruparse de tal modo que sus interacciones con el agua sean lo más mínimo posible, y esto lo logra formando estructuras 3D como las mostradas arriba.
Así, las moléculas de grasas, como los fosfolípidos, se unen para formar bicapas lipídicas, micelas y liposomas.
Si se observa, estas moléculas poseen una cabeza de color blanco que representa una porción polar, afín al agua; así como una cola apolar, que repele a las moléculas del agua. Las colas buscan situarse en el interior de estas estructuras supramoleculares, de manera que no interaccionen con el agua.
