¿Qué es la masa atómica?
En química se llama masa atómica a la masa de un átomo, la cual se compone del total de la masa de protones y neutrones.
La masa atómica es diferente al peso atómico, a la masa atómica relativa, al número atómico y al número másico o número de masa.
La masa atómica se encuentra representada en la tabla periódica de los elementos. Observemos los ejemplos a continuación.
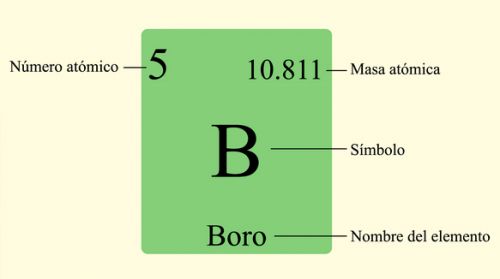
Representación de la masa atómica de los elementos en la tabla periódica.

Masa atómica del oxígeno, el aluminio y el carbono en la tabla periódica.
Unidades de masa atómica
La unidad de medida de la masa atómica se conoce como “uma”, que resulta de la abreviación de “unidades de masa atómica”. También se conoce como “u”, que resume “unidades de masa atómica unificada”, y como “Da”, que significa “Dalton”.
Esta unidad se define como la 1/12 parte que posee un átomo de carbono 12 (C-12). Así, 1 uma corresponde a 1,66053904 x 1024 gramos.
Por ejemplo, el átomo del carbono 12 (C-12) en particular posee 12 unidades de masa atómica (u=12).
Peso atómico
El peso atómico se define como el promedio de la masa atómica de todos los isótopos de un elemento.
Por ejemplo, el peso atómico del carbono, que se calcula a partir de la media entre diferentes isótopos de carbono como el C-12 y el C-14, es de 12,0107.
Número atómico
El número atómico corresponde a la cantidad de protones que contiene cada átomo de un elemento. Este se representa con la letra Z. Por ejemplo, el número atómico del carbono (C) es 6 (Z=6).
Número de masa
El número de masa o número másico se refiere al total de protones y neutrones del núcleo del átomo.
Masa atómica relativa
Si se quiere calcular la masa atómica de un elemento, y no solo de un átomo, se habla de masa atómica relativa y se representa con las siglas “Ar”. Veamos.
Los elementos se pueden encontrar en la naturaleza de diferentes formas, lo que en términos químicos quiere decir que pueden estar conformados por varios isotopos.
Se habla de isotopos para referir a los átomos con diferente número de neutrones pero el mismo número de protones. Por lo tanto, la masa de cada isótopo es distinto. Así, la masa atómica relativa corresponde a la media de las masas de los isotopos de cada elemento.
