¿Qué es el estado gaseoso?
Se llama estado gaseoso a un estado de la materia que consiste en el agrupamiento de átomos y moléculas con poca fuerza de atracción entre sí o en expansión, lo que significa que no pueden unirse totalmente.
La materia en estado gaseoso se llama gas. La palabra gas deriva de la voz latina chaos que significa “caos”. Fue acuñada por el químico Jan Baptista van Helmont en el siglo XVII.
El estado gaseoso es uno de los estados de agregación de la materia, junto con los estados líquido, sólido, plasmático y Bose-Einstein.

Agua en proceso de evaporación o ebullición.
Algunos ejemplos de materia en estado gaseoso son:
- gas oxígeno (O2);
- gas carbónico (CO2);
- gas natural (usado como combustible);
- gases nobles como el helio (He); argón (Ar); neón (Ne); kriptón (Kr); xenón (Xe), radón (Rn) y oganesón (Og).
- nitrógeno (N2);
- vapor de agua;
- nubes;
- biogás;
- gas lacrimógeno;
- humo de las chimeneas y fogatas;
- humo que desprenden los fósforos;
- gas refrigerante.
El agua es el único elemento que se puede encontrar en todos los estados de agregación de la materia de forma natural (sólido, líquido y gaseoso).
Características del estado gaseoso

Diferentes gases en sus recipientes.
En el estado gaseoso, la energía de separación entre las moléculas y átomos excede la fuerza de atracción entre ellas, lo que da lugar a una serie de características o propiedades de los gases.
- Los gases contienen menos partículas que líquidos y sólidos.
- Las partículas están muy separadas entre sí, por lo que su interacción es poca.
- Las partículas están en movimiento constante y desordenado.
- Los gases no tienen forma ni volumen definidos.
- Cuando hay colisiones entre partículas, estas cambian de dirección y velocidad de forma caótica, lo que aumenta su alejamiento y el volumen del gas.
- La mayoría de los gases son intangibles, incoloros e insaboros.
- Los gases pueden ocupar todo el volumen que tengan disponible.
- Los gases pueden ser comprimidos hasta adoptar la forma de su recipiente.
Cambios de estado de la materia gaseosa
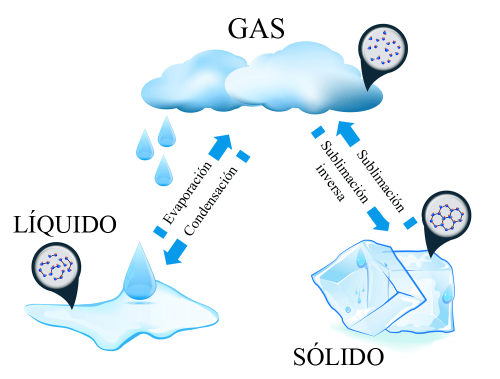
Cambios de estado de la materia gaseosa. Nótese también la separación entre partículas según el estado de la materia.
De acuerdo a las variables de temperatura y presión, pueden generarse procesos de transformación de la materia de un estado de agregación o otro. Los cambios de la materia que involucran el estado gaseoso son los siguientes:
Condensación o licuación
Es el paso del estado gaseoso al estado líquido. Ocurre cuando un gas es sometido a un descenso de su temperatura, lo que reduce el movimiento de las partículas y favorece que se contraigan entre sí hasta convertirse en líquido. Podemos señalar dos ejemplos cotidianos con el agua: 1) cuando las nubes se transforman en precipitaciones. 2) cuando un vaso con una bebida fría produce gotas de agua en su exterior al condensar el aire caliente de la atmósfera.
Evaporación o ebullición
Es la transformación del estado líquido al estado gaseoso. Ocurre cuando un líquido es sometido a un aumento de temperatura por hasta alcanzar el punto de ebullición. Un ejemplo lo podemos ver cuando el agua hierve en la cazuela hasta evaporarse.
Sublimación
Es el cambio del estado sólido al estado gaseoso sin tener que pasar por el estado líquido. La sublimación ocurre gracias a temperaturas tan extremas que no permiten la formación de líquido. Un ejemplo de sublimación lo encontramos en el hielo seco que se desprende en vapor sin pasar por el estado líquido.
Sublimación inversa o deposición
Es el cambio del estado sólido al estado gaseoso sin tener que pasar por el estado líquido. Un ejemplo de sublimación inversa es la formación de escarcha en el suelo.
Factores que afectan los gases

Cuando se calienta el aire (gas) dentro del globo, aumenta el volumen y, por lo tanto, se eleva.
El comportamiento de los gases se encuentra afectado por las siguientes variables:
- Volumen (V): es el espacio que ocupa la materia gaseosa, el cual se mide en litros (L). El gas tendrá mayor o menor volumen según la separación entre las partículas y el espacio disponible para expandirse.
- Presión (P): es la fuerza aplicada por área. La presión tiene su origen en el peso del aire, por lo tanto, mientras más alto sube un gas, menos presión experimenta debido a la menor cantidad de aire. En el caso de los gases, la presión se mide en atmósferas (atm).
- Temperatura (T): es la medida de energía cinética producida entre las partículas del gas, la cual se mide en unidades kelvin (K). Si un cuerpo de materia fría se aproxima a otro caliente, el cuerpo frío elevará su temperatura.
Estos factores se relacionan a su vez con otros elementos inherentes a los gases como:
- Cantidad: es la cantidad de masa de la materia gaseosa y se mide en moles (n).
- Densidad: se refiere a la relación que entre el volumen y el peso.
Vea también:
Leyes de los gases o leyes del estado gaseoso
Se llaman leyes de los gases a los modelos interpretativos que describen la relación entre las diferentes variables que afectan el comportamiento de los gases (temperatura, presión, cantidad y volumen). Existen cuatro leyes de los gases, cada una enfocada en diferentes aspectos de los gases. Estas se conocen como:
- Ley de Boyle: se ocupa de la relación entre presión y volumen.
- Ley de Charles: establece la relación entre temperatura y volumen.
- Ley de Gay-Lussac: estudia la relación entre presión y temperatura.
- Ley de Avogadro: analiza la relación entre el volumen y la cantidad de moles.
La combinación de estas cuatro leyes da lugar a la ley de los gases ideales.
Ley de los gases ideales
Se llaman gases ideales a aquellos cuyas partículas no presentan ni atracción ni repulsión, o sea, que no existen fuerzas atractivas intermoleculares. Los gases ideales reciben este nombre porque son, en realidad, un supuesto teórico.
La ley del gas ideal es representada por la siguiente fórmula:
PV = nRT = NkT
donde:
- P: presión
- V: volumen
- n: número de moles
- R: constante universal de gas (8.3145 J/mol k)
- N: N° de moléculas
- k: constante de Boltzmann (8.617385 x 10-5eV/k)
- T: temperatura
La ley de los gases ideales relaciona al mismo tiempo la presión, el volumen, la temperatura y la masa de un gas en condiciones estándar.
