Hidrocarburos alifáticos: propiedades, nomenclatura, reacciones, tipos
Los hidrocarburos alifáticos son todos aquellos que carecen de aromaticidad, no en un sentido olfativo, sino en lo que respecta a la estabilidad química. Clasificar a los hidrocarburos de este modo resulta hoy en día demasiado ambiguo e impreciso, ya que no discrimina entre varios tipos de hidrocarburos que no son aromáticos.
Así, tenemos hidrocarburos alifáticos e hidrocarburos aromáticos. Estos últimos se reconocen por su unidad básica: el anillo bencénico. Los otros, en cambio, pueden adoptar cualquier estructura molecular: lineal, ramificada, cíclica, insaturada, policíclica; siempre y cuando no tengan sistemas conjugados como el del benceno.

El término ‘alifático’ nació de la palabra griega ‘aleiphar’, que significa grasa, utilizada también para referirse a los aceites. Por lo tanto, en el siglo XIX se les asignó esta clasificación a los hidrocarburos obtenidos de los extractos aceitosos; mientras que los hidrocarburos aromáticos se extraían de resinas arbóreas y fragantes.
No obstante, a medida que se consolidaron las bases de la química orgánica, se descubrió que había una propiedad química que diferenciaban a los hidrocarburos, aún más importante que sus fuentes naturales: la aromaticidad (y no la fragancia).
De esta manera, los hidrocarburos alifáticos dejaron de ser únicamente los obtenidos de las grasas, para ser todos aquellos carentes de aromaticidad. Dentro de esta familia tenemos a los alcanos, alquenos y alquinos, sin importar que sean lineales o cíclicos. Es por eso que ‘alifático’ se considera impreciso; aunque es útil para abordar algunos aspectos generales.
Por ejemplo, cuando se dice ‘extremos’ o ‘cadenas’ alifáticos, se alude a regiones moleculares donde están ausentes los anillos aromáticos. De todos los hidrocarburos alifáticos, el más simple por definición es el metano, CH4; mientras que el benceno es el más simple de los hidrocarburos aromáticos.
Índice del artículo
- 1 Propiedades de los de los hidrocarburos alifáticos
- 2 Nomenclatura
- 3 Reacciones
- 4 Tipos
- 5 Usos
- 6 Ejemplos
- 7 Referencias
Las propiedades de los hidrocarburos alifáticos oscilan en distintos grados dependiendo de cuáles se consideran. Los hay de baja y alta masas moleculares, así como lineales, ramificados, cíclicos o policíclicos, incluso los de estructuras tridimensionales asombrosas; tal como ocurre con el cubano, en forma de cubo.
Sin embargo, hay algunas generalidades que pueden mencionarse. La mayoría de los hidrocarburos alifáticos son gases o líquidos hidrofóbicos y apolares, habiendo algunos más apolares que otros, pues se incluyen en la lista incluso aquellos en cuyas cadenas carbonadas poseen átomos de halógenos, oxígeno, nitrógeno o azufre.
Asimismo, son compuestos inflamables, ya que son susceptibles a oxidarse en el aire ante una mínima fuente de calor. Esta característica se vuelve más peligrosa si añadimos su alta volatilidad, debido a las débiles interacciones dispersivas que mantienen cohesionadas las moléculas alifáticas.
Esto por ejemplo lo vemos en el butano, un gas que puede licuarse con relativa facilidad al igual que el propano. Ambos son muy volátiles e inflamables, por lo que son componentes activos del gas de cocina o de los encendedores de bolsillo.
Por supuesto, dicha volatilidad tiende a disminuir conforme aumenta la masa molecular y el hidrocarburo origine líquidos cada vez más viscosos y aceitosos.
La nomenclatura de los hidrocarburos difiere todavía más que sus propiedades. Si son alcanos, alquenos o alquinos, se sigue las mismas normas estipuladas por la IUPAC: seleccionar la cadena más larga, asignando los números indicadores más bajos al extremo más sustituido o a los heteroátomos o grupos más reactivos.
De esta manera se sabe en qué carbono se encuentran cada sustituyente, o inclusive las insaturaciones (dobles o triple enlaces). Para el caso de los hidrocarburos cíclicos, el nombre viene precedido por los sustituyentes enumerados en orden alfabético, seguidos de la palabra ‘ciclo’, contando los números de carbono que lo integran.
Por ejemplo, considérese los dos ciclohexanos siguientes:
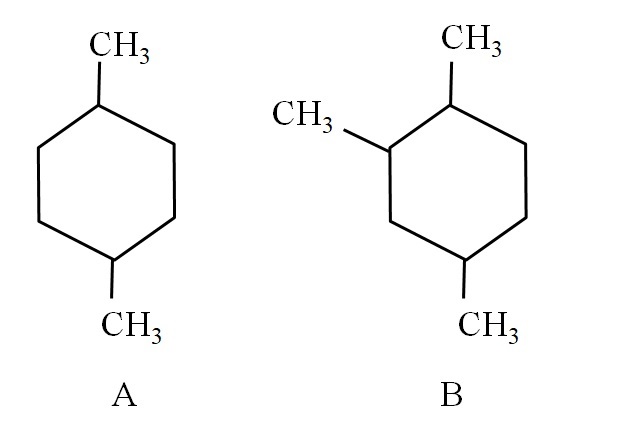
El ciclohexano A, se llama 1,4-dimetilciclohexano. Si el anillo fuera de cinco carbonos, sería el 1,4-dimetilciclopentano. Mientras, el ciclohexano B se llama 1,2,4-trimetilciclohexano, y no 1,4,6-ciclohexano, pues se busca utilizar los indicadores más bajos.
Ahora bien, la nomenclatura puede tornarse muy complicada para los hidrocarburos de estructuras estrambóticas. Para ellos existen reglas más específicas, las cuales deben explicarse por separado y detenidamente; tal como sucede con los dienos, terpenos, polienos, y los compuestos policíclicos.
Por suerte, las reacciones son menos variadas para estos hidrocarburos. Una de ellas ya se mencionó: combustionan fácilmente, produciendo dióxido de carbono y agua, además de otros óxidos o gases dependiendo de la presencia de heteroátomos (Cl, N, P, O, etc.). Sin embargo, el CO2 y H2O son los productos principales de la combustión.
Si presentan insaturaciones pueden sufrir reacciones de adición; es decir, incorporan moléculas pequeñas a su esqueleto como sustituyentes siguiendo un mecanismo específico. Entre estas moléculas tenemos a la del agua, al hidrógeno y los halógenos (F2, Cl2, Br2 y I2).
Por otro lado, los hidrocarburos alifáticos bajo la incidencia de radiación ultravioleta (hv) y calor pueden romper enlaces C-H para cambiarlos por enlaces C-X (C-F, C-Cl, etc.). Esta es la reacción de halogenación, la cual se observa en alcanos de cadena muy corta, como el metano o pentano.
Otra reacción que pueden sufrir los hidrocarburos alifáticos, especialmente los alcanos de cadena larga, es el craqueo térmico. Consiste en la suministración de calor intenso para que la energía térmica rompa los enlaces C-C, y así se formen moléculas pequeñas, más cotizadas en el mercado de los combustibles, a partir de moléculas grandes.
Las cuatro reacciones de arriba son las principales que pueden sufrir un hidrocarburo alifático, siendo la combustión la más importante de todas, pues no discrimina a ningún compuesto; todos arderán en presencia de oxígeno, pero no todos adicionarán moléculas ni se romperán en moléculas pequeñas.
Los hidrocarburos alifáticos agrupan un sinfín de compuestos, los cuales a su vez se clasifican de modo más específicos, indicando el grado de sus insaturaciones, así como el tipo de estructura que tienen.
De acuerdo a qué tan insaturado son, tenemos los alcanos (saturados), alquenos y alquinos (insaturados).
Los alcanos se caracterizan por tener enlaces simples C-C, mientras que en los alquenos y alquinos observamos enlaces C=C y C≡C, respectivamente. Una manera muy general de visualizarlos es pensar en los esqueletos carbonados de los alcanos como cadenas zigzagueantes y dobladas, siendo “cuadrados” para los alquenos, y “líneas rectas” para los alquinos.
Esto se debe a que los dobles y triples enlaces presentan restricción energética y estérica en sus rotaciones, “endureciendo” sus estructuras.
Los alcanos, alquenos y alquinos pueden ser ramificados, cíclicos o policíclicos. Es por eso que los cicloalcanos, cicloalquenos, cicloalquinos, y los compuestos como la decalina (de estructura biciclo), adamantano (parecido a una gorra de béisbol), heptaleno, gonano, entre otros, se consideran también hidrocarburos alifáticos.
De los alquenos surgen otros tipos de hidrocarburos, tales como los dienos (con dos dobles enlaces), polienos (con muchos dobles enlaces alternados), y terpenos (compuestos derivados del isopreno, un dieno).
Nuevamente, los usos para estos hidrocarburos pueden variar dependiendo de cuál se considere. Sin embargo, en los apartados de propiedades y reacciones se dejó claro que todos combustionan, no solo para liberar moléculas gaseosas, sino también luz y calor. Así pues, son reservorios de energía, útiles para servir como combustibles o fuentes de calor.
Es por eso que se utilizan como parte de la composición de la gasolina, para el gas natural, en los mecheros Bunsen, y en general para poder originar fuego.
Uno de los ejemplos más destacables es el del acetileno, HC≡CH, cuya combustión permite excitar los iones metálicos de una muestra en la espectrometría de absorción atómica realizada en ensayos analíticos. Asimismo, el fuego resultante puede utilizarse para las soldaduras.
Los hidrocarburos alifáticos líquidos, como los parafínicos, se utilizan frecuentemente como solventes de extracción para grasas. Además, su acción disolvente puede utilizarse para remover manchas, esmaltes, pinturas, o sencillamente para preparar disoluciones de un compuesto orgánico determinado.
Los de mayor masa molecular, ya viscosos o sólidos, se destinan para la elaboración de resinas, polímeros o medicinas.
En lo que respecta al término ‘alifático’, suele utilizarse para referirse a aquellas regiones, en una macromolécula, que carecen de aromaticidad. Por ejemplo, los asfaltenos se describen superficialmente como un núcleo aromático con cadenas alifáticas.
Al principio se dijo que el metano es el más simple de los hidrocarburos alifáticos. Le siguen el propano, CH3CH2CH3, butano, CH3CH2CH2CH3, pentano, CH3CH2CH2CH2CH3, octano, nonano, decano, y así sucesivamente, teniendo alcanos cada vez más largos.
Lo mismo aplica para el etileno, CH2=CH2, propeno, CH3CH=CH2, buteno, CH3CH2CH=CH3, y para el resto de los alquinos. Si hay dos dobles enlaces, se tratan de dienos, y si hay más de dos, polienos. Igualmente, puede haber dobles y triples enlaces en un mismo esqueleto, aumentando la complejidad estructural.
Entre los cicloalcanos podemos mencionar al ciclopropano, ciclobutano, ciclopentano, ciclohexano, cicloheptano, ciclooctano, así como el ciclohexeno y ciclohexino. De todos estos hidrocarburos se obtienen a su vez derivados ramificados, multiplicándose todavía más los ejemplos disponibles (como el 1,4-dimetilciclohexano).
De los terpenos más representativos tenemos al limoneno, el mentol, el pineno, la vitamina A, el escualeno, etc. El polietileno es un polímero saturado con unidades -CH2-CH2-, por lo que también es un ejemplo de estos hidrocarburos. Otros ejemplos se han citado ya en los apartados anteriores.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Helmenstine, Anne Marie, Ph.D. (22 de agosto de 2019). Aliphatic Hydrocarbon Definition. Recuperado de: thoughtco.com
- Wikipedia. (2019). Aliphatic compound. Recuperado de: en.wikipedia.org
- Chemistry LibreTexts. (20 de agosto de 2019). Aliphatic Hydrocarbons. Recuperado de: chem.libretexts.org
- Elizabeth Wyman. (2019). Aliphatic Hydrocarbons: Definition & Properties. Study. Recuperado de: study.com
