Ionización en física y química: concepto, proceso y ejemplos
La ionización es todo aquel proceso en el que se generan cargas eléctricas a partir de partículas neutras. Esta puede tener lugar mediante diversos mecanismos o fuerzas naturales, ya sea por radiación, calor, campos eléctricos, campos magnéticos o reacciones químicas. Se producen como consecuencia iones, los cuales son átomos cargados positiva o negativamente.
La ionización es un proceso fundamental para sinfines de fenómenos físicos, químicos o naturales, siendo estos últimos muchas veces una mezcla de cambios fisicoquímicos. Por ejemplo, en las ionizaciones físicas, en principio, no ocurren reacciones químicas; es decir, la producción de los iones no implica el rompimiento o la formación de nuevos enlaces.

No obstante, en los fenómenos naturales dicha ionización suele venir acompañada de reacciones químicas, tal como la formación de ozono a bajas altitudes. Asimismo, durante las tormentas eléctricas se generan óxidos de nitrógeno a causa de los rayos y sus intensas temperaturas, las cuales oxidan el nitrógeno del aire.
Por otro lado, la ionización puede transcurrir sigilosamente: en el seno de la misma agua, en el frotamiento entre dos superficies, en las oxidaciones de los metales o en la disolución de ciertos gases en agua.
Índice del artículo
- 1 Ionización en química
- 2 Ionización en física
- 3 Ionización del agua
- 4 Ionización del aire
- 5 Ejemplos de ionización
- 6 Referencias

En la ionización química se producen iones mediante el rompimiento o la formación de enlaces. Dos sustancias ganan o pierden electrones irreversiblemente: la que pierde los electrones adquiere una carga positiva, mientras la que los gana conserva una carga negativa.
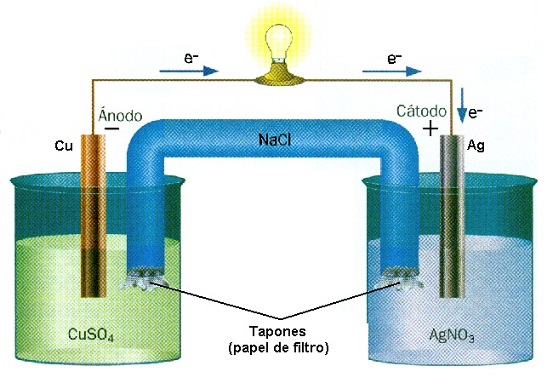
En las pilas una sustancia pierde electrones mientras otra los gana. Estos electrones recorren y activan los circuitos eléctricos de un equipo, para finalmente regresar a un segundo compartimiento de la pila, donde la otra sustancia aguarda por ellos para atraparlos y cargarse negativamente. Este es un ejemplo de una ionización química llevada a cabo por una reacción de óxido-reducción.
Otro tipo de ionización química se debe a la ruptura heterolítica. Cuando ocurre esta ruptura, el enlace A-B se rompe para formar los iones A+ y B–, pues los electrones se dirigen hacia el átomo por el que “sienten” mayor afinidad. La ruptura heterolítica por lo general es el primer paso que gobierna los mecanismos de muchas reacciones orgánicas.
Las cargas eléctricas no solo pueden aparecer por el movimiento de electrones en sí mismo, sino por los enlaces que se rompen o forman en un intercambio de átomos. Este es el caso de la autoionización, la cual sucede entre dos moléculas de un mismo compuesto.
De todas las ionizaciones químicas, la autoionización es la más simple e imperceptible, pues no tiene la habilidad de conducir la corriente eléctrica por sí misma.

La ionización también tiene mucha participación en fenómenos físicos. En general, la ionización en la física no implica reacciones químicas. Los átomos de la materia se cargan eléctricamente sin que pierdan su identidad original.
Las superficies pueden intercambiar electrones cuando se frotan si una de ellas es más eficaz para almacenarlos, lo que conduce a la electricidad estática. Ya no se habla solamente de átomos, sino de todo un material que adquiere una carga negativa o positiva, y que al restablecerse el equilibrio, puede generarse literalmente una descarga eléctrica entre dos materiales o cuerpos.
Los átomos gaseosos dispersos pueden perder electrones si se les someten a un campo eléctrico. Al hacerlo, los átomos se excitan y liberan electrones. Luego, al enfriarse y retornar a su estado de menor energía, despiden fotones. Y el proceso se repite una y otra vez. El resultado: una fuente de iluminación o de electricidad.
Similarmente, la materia puede ganar energía aportada por distintos tipos de radiaciones (gamma, rayos X, ultravioleta, etc.) o por colisionar con partículas de altas energías (alfas, betas y neutrones).
La energía aportada es tal, que se desprende al instante un electrón del átomo. Este tipo de ionización está relacionada con múltiples fenómenos radiactivos y cósmicos.
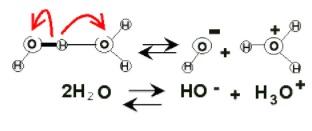
En el seno del agua pueden aparecer cargas eléctricas a causa de su ionización. Esta es del tipo químico, pues dos moléculas de agua reaccionan de pronto entre sí para disociarse y generar los iones H3O+ y OH–:
2H2O(l) ⇌ H3O+(ac) + OH–(ac)
Este equilibrio se haya muy desplazado hacia el agua, por lo que apenas se produce una cantidad despreciable de estos iones.
Las moléculas del aire no participan en ningún equilibrio de autoionización. El oxígeno, el nitrógeno, el argón, el vapor de agua y los otros gases que componen el aire, no andan intercambiando átomos ni electrones. Por lo tanto, el aire no es un buen conductor de la electricidad en condiciones normales.
No obstante, si se le somete a un campo eléctrico, a radiaciones, o a intensas temperaturas, puede ionizarse y volverse un buen conductor. Esto es lo que sucede, por ejemplo, cuando los rayos eléctricos caen desde las nubes hasta la tierra, viajando los electrones a través del aire con súbita explosión luminosa.
A lo largo de los apartados anteriores se han nombrado algunos ejemplos de ionización. Para finalizar, se mencionarán algunos otros.
Cuando los metales se oxidan, ya sea por acción del oxígeno terrestre o por el ataque de sustancias ácidas, adquieren cargas positivas para formar óxidos o sales, respectivamente.
Por ejemplo, el hierro se ioniza gracias al oxígeno para transformarse en iones Fe3+, ubicados en los cristales de los óxidos de hierro. El magnesio, por otra parte, se disuelve en ácido sulfúrico para perder electrones y quedar como iones Mg2+ en la sal sulfato de magnesio.
Algunos gases, como el amoníaco y el cloruro de hidrógeno, se disuelven en el agua para perder su neutralidad y dar lugar a la formación de iones. Por ejemplo, el amoníaco cuando se disuelve libera parcialmente iones NH4+ y OH–. Mientras, el cloruro de hidrógeno al disolverse producirá iones H3O+ y Cl– de manera completa.
Un caso similar es el de la disolución de sales en agua, como el sulfato de magnesio, MgSO4. Sin embargo, los iones Mg2+ y SO42- ya están presentes en los cristales de la sal antes de disolverse en el agua.

En las lámparas de vapor o en los tubos de iluminación se excitan los átomos gaseosos con descargas eléctricas para producir cierta cantidad de luz y colores. Por ejemplo, esta ionización tiene lugar en las lámparas de sodio o de mercurio, así como en las famosas luces de neón con sus brillantes colores en las entradas de restaurantes o tiendas.
La energía de ionización, una propiedad periódica, se estudia para caracterizar los elementos químicos según la facilidad con que sus átomos gaseosos donan sus electrones para cargarse positivamente. Así por ejemplo, los metales suelen tener las energías de ionización más bajas, mientras que los elementos no metálicos y los gases nobles, las más altas.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Serway, R., Jewett, J. (2008). Física para Ciencias e Ingeniería. Volumen 1. 7ma. Edición. México. Cengage Learning Editores.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Ionization. Recuperado de: en.wikipedia.org
- The Editors of Encyclopaedia Britannica. (17 de octubre de 2016). Ionization. Encyclopædia Britannica. Recuperado de: britannica.com
- Doug Stewart. (2018). Definition of Ionization: What is Ionization? Recuperado de: chemicool.com
- John Zavisa. (01 de abril de 2020). How Lightning Works. Recuperado de: science.howstuffworks.com
