Óxido de hierro: qué es, estructura, propiedades, nomenclatura, usos

¿Qué es el óxido de hierro?
El óxido de hierro es cualquiera de los compuestos formados entre el hierro y el oxígeno. Se caracterizan por ser iónicos y cristalinos, y yacen esparcidos producto de la erosión de sus minerales, componiendo los suelos, la masa vegetal e, incluso, el interior de los organismos vivos.
Es una de las familias de compuestos que predominan en la corteza terrestre. Se conocen hasta la fecha dieciséis óxidos de hierro, siendo la mayoría de ellos de origen natural y otros sintetizados bajo condiciones extremas de presión o temperatura.
En la imagen superior se muestra una porción de óxido férrico en polvo. Su color rojo característico reviste el hierro de varios elementos arquitectónicos en lo que se conoce como herrumbre. Asimismo, se observa en las laderas, montañas o suelos, mezclado con otros tantos minerales, como el polvo amarillo de la goethita (α-FeOOH).
Los óxidos de hierro más conocidos son la hematita (α-Fe2O3) y maghemita (ϒ- Fe2O3), ambos polimorfos del óxido férrico; y no menos importante, la magnetita (Fe3O4).
Sus estructuras polimórficas y su gran área superficial los hacen materiales interesantes como sorbentes, o para la síntesis de nanopartículas con amplias aplicaciones.
Estructura de los óxidos de hierro
La imagen superior es una representación de la estructura cristalina del FeO, uno de los óxidos de hierro donde el hierro tiene valencia +2. Las esferas rojas corresponden a los aniones O2-, mientras que las amarillas a los cationes Fe2+.
Nótese también que cada Fe2+ está rodeado de seis O2-, formando una unidad octaédrica de coordinación.
Por lo tanto, la estructura del FeO puede “desmenuzarse” en unidades de FeO6, donde el átomo central es el Fe2+. En el caso de los oxihidróxidos o hidróxidos la unidad octaédrica es FeO3(OH)3.
En algunas estructuras, en lugar del octaedro, se encuentran unidades tetraédricas, FeO4. Por esta razón las estructuras de los óxidos de hierro suelen representarse con octaedros o tetraedros con centros de hierro.
Las estructuras de los óxidos de hierro dependen de las condiciones de presión o temperatura, de la relación Fe/O (es decir, cuántos oxígenos hay por hierro y viceversa), y de la valencia del hierro (+2, +3 y, muy raras veces en óxidos sintéticos, +4).
En general, los voluminosos aniones O2- se alinean formando láminas cuyos huecos alojan a los cationes Fe2+ o Fe3+. Así, existen óxidos (como la magnetita) que tienen hierros con ambas valencias.
Polimorfismo
Los óxidos de hierro presentan polimorfismo, es decir, diferentes estructuras o arreglos cristalinos para un mismo compuesto. El óxido férrico, Fe2O3, tiene hasta cuatro polimorfos posibles. La hematita, α-Fe2O3, es la más estable de todas; seguida por la maghemita, ϒ- Fe2O3, y por las sintéticas β- Fe2O3 y ε- Fe2O3.
Todas ellas tienen sus propios tipos de estructuras y sistemas cristalinos. Sin embargo, la proporción 2:3 se mantiene constante, por lo que hay tres aniones O2- por cada dos cationes Fe3+.
La diferencia radica en cómo se ubican las unidades octaédricas FeO6 en el espacio y cómo estas se unen.
Enlaces estructurales
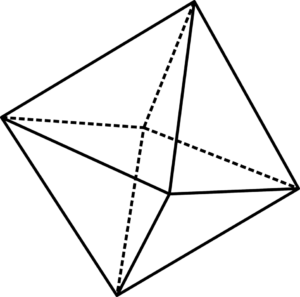
Las unidades octaédricas FeO6 pueden visualizarse con ayuda de la imagen superior. En las esquinas del octaedro se encuentran los O2-, mientras que en su centro el Fe2+ o Fe3+(para el caso del Fe2O3). La manera en la que estos octaedros se disponen en el espacio revelan la estructura del óxido.
Sin embargo, también influyen el cómo se enlazan. Por ejemplo, dos octaedros pueden unirse tocando dos de sus vértices, lo cual se representa con un puente de oxígeno: Fe-O-Fe. Del mismo modo, los octaedros pueden unirse a través de sus bordes (adyacentes uno del otro). Se representaría entonces con dos puentes de oxígeno: Fe-(O)2-Fe.
Y por último, los octaedros pueden interactuar mediante sus caras. Así, la representación sería ahora con tres puentes de oxígeno: Fe-(O)3-Fe. Del modo en que se enlacen los octaedros, variaría las distancias internucleares Fe-Fe y, por tanto, las propiedades físicas del óxido.
Propiedades de los óxidos de hierro
Un óxido de hierro es un compuesto con propiedades magnéticas. Estas pueden ser anti, ferro o ferrimagnéticas, y dependen de las valencias del Fe y de cómo interactúan los cationes en el sólido.
Debido a que las estructuras de los sólidos son muy variadas, del mismo modo lo son sus propiedades físicas y químicas.
Por ejemplo, los polimorfos e hidratos del Fe2O3 tienen valores distintos de puntos de fusión (los cuales oscilan entre 1.200 y 1.600 °C) y densidades. No obstante, tienen en común la poca solubilidad a raíz del Fe3+, la misma masa molecular, son de colores pardos y se disuelven escasamente en soluciones ácidas.
Nomenclatura de los óxidos de hierro
La IUPAC establece tres maneras para nombrar un óxido de hierro. Las tres son muy útiles, aunque para óxidos complejos (como el Fe7O9) la sistemática gobierna sobre las otras por su sencillez.
Nomenclatura sistemática
Se toman en consideración los números de oxígeno y hierro, nombrándolos con los prefijos de numeración griegas mono-, di-, tri-, etc. De acuerdo a esta nomenclatura el Fe2O3 se llama: trióxido de dihierro. Y para el Fe7O9 su nombre sería: nonaóxido de heptahierro.
Nomenclatura stock
Esta considera la valencia del hierro. Si se trata del Fe2+, se escribe óxido de hierro…, y su valencia con números romanos encerrados entre paréntesis. Para el Fe2O3 su nombre es: óxido de hierro (III).
Nótese que el Fe3+ puede determinarse mediante las sumas algebraicas. Si el O2- tiene dos cargas negativas, y hay tres de ellos, suman -6. Para neutralizar este -6 se requieren de +6, pero hay dos Fe, de modo que deben dividirse entre dos, +6/2= +3:
2X (valencia del metal) + 3(-2) = 0
Despejando sencillamente X se obtiene la valencia del Fe en el óxido. Pero si X no es un número entero (como ocurre con casi todos los óxidos restantes), entonces hay una mezcla de Fe2+ y Fe3+.
Nomenclatura tradicional
El sufijo –ico se le concede al prefijo ferr- cuando el Fe tiene valencia +3, y –oso cuando su valencia es 2+. Así, el Fe2O3 se llama: óxido férrico.
Usos de los óxidos de hierro
Nanopartículas
Los óxidos de hierro tienen en común una alta energía de cristalización, la cual permite crear cristales muy pequeños pero con gran área superficial.
Por esta razón son de gran interés en los campos de la nanotecnología, donde diseñan y sintetizan nanopartículas de óxidos (NPs) para propósitos específicos:
- Como catalizadores.
- Como reservorio de drogas o genes dentro del organismo.
- En el diseño de superficies sensoriales para distintos tipos de biomoléculas: proteínas, azúcares, grasas.
- Para almacenar datos magnéticos.
Pigmentos
Debido a que algunos óxidos son muy estables, sirven para teñir textiles o darles colores brillantes a las superficies de cualquier material. Desde los mosaicos de los pisos –las pinturas rojas, amarillas y anaranjadas (incluso verdes)–, cerámicas, plásticos, cueros hasta obras de arquitectura.
Referencias
- Trustees of Dartmouth College (18 de marzo de 2004). Stoichiometry of Iron Oxides. Tomado de: dartmouth.edu
- Ryosuke Sinmyo et al. (08 de septiembre de 2016). Discovery of Fe7O9: a new iron oxide with a complex monoclinic structure. Recuperado de: nature.com
- M. Cornell, U. Schwertmann. The Iron Oxides: Structure, Properties, Reactions, Occurrences and Uses [PDF]. WILEY-VCH. Tomado de: epsc511.wustl.edu
- Alice Bu (2018). Iron Oxide Nanoparticles, Characteristics and Applications. Tomado de: sigmaaldrich.com
- Golchha Pigments (2009). Iron Oxides: Applications. Tomado de: golchhapigments.com
- Formulación química (2018). Óxido de hierro (II). Tomado de: formulacionquimica.com
- Wikipedia (2018). Iron (III) oxide. Tomado de: https://en.wikipedia.org/wiki/Iron(III)_oxide
