Medio Cary Blair: fundamento, preparación y usos
El medio Cary Blair es un agar semisólido, utilizado para el transporte y conservación de muestras biológicas que alberguen patógenos intestinales, microorganismos lábiles y anaerobios. Como todo medio de transporte su función es mantener la muestra en condiciones óptimas hasta que sea cultivada. Los microorganismos patógenos presentes, así como la microbiota acompañante deben mantenerse viables, pero sin aumentar su población.
El medio Cary Blair es el resultado del cambio de formulación del medio de transporte Stuart. La modificación fue realizada en 1964 y consistió en sustituir el sistema regulador de pH (glicerofosfato) por un tampón inorgánico fosfatado.
La reformulación fue necesaria debido a que sus creadores se dieron cuenta de que el glicerofosfato después de cierto tiempo podía ser metabolizado por algunas bacterias saprófitas. Estas al multiplicarse solapan a los patógenos presentes.
Otros de los cambios fue la eliminación del azul de metileno, así como un reajuste del pH hacia la alcalinidad (pH 8,4). Todos estos cambios mejoraron la eficiencia del medio de transporte.
Originalmente el medio Cary Blair era utilizado para el mantenimiento de patógenos intestinales, tales como Shigella flexneri, Salmonella sp, Vibrio cholerae y Campylobacter sp.
Sin embargo, posteriormente se ha visto la eficacia en la conservación de la viabilidad de microorganismos patógenos exigentes y lábiles, tales como: Neisseria gonorrhoeae, Haemophilus influenzae, Neisseria meningitidis, Bordetella pertussis, Streptococcus pneumoniae y algunos anaerobios.
Índice del artículo
- 1 Fundamento
- 2 Preparación
- 3 Uso
- 4 Investigaciones realizadas sobre el medio de transporte Cary Blair
- 5 Control de calidad
- 6 Referencias
El medio Cary Blair contiene cloruro de sodio, tioglicolato de sodio, fosfato disódico, cloruro de calcio y agar.
El cloruro de sodio mantiene el equilibrio osmótico del medio, el fosfato disódico y el cloruro de calcio equilibran el pH. Por su parte, el tioglicolato de sodio mantiene un bajo potencial de óxido-reducción, mientras que la pequeña porción de agar proporciona la consistencia semisólida.
El medio Cary Blair no contiene sustancias nutritivas, ya que la función de un medio de transporte es mantener la muestra sin que la misma sufra modificaciones en cuanto a la humedad y la carga microbiana; es decir, evita la deshidratación de la muestra conservando la viabilidad y la cantidad de los microorganismos presentes.
Finalmente, el pH ligeramente alcalino evita la muerte de los microorganismos por acidez, especialmente los Vibrios son muy sensibles a los ácidos.
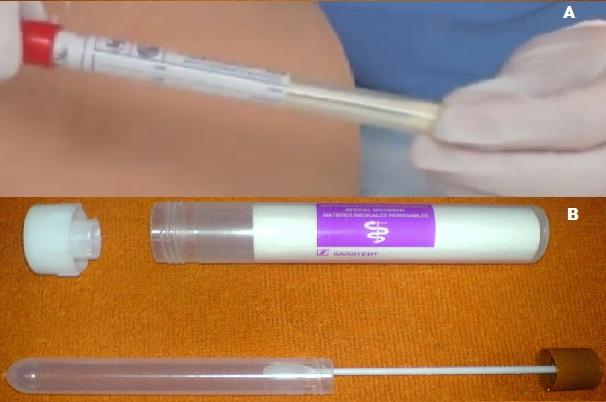
El medio Cary Blair puede adquirirse comercialmente como un dispositivo especial listo para su uso. El sistema de transporte viene cubierto por una bolsa de Peel Pack plástico. En su interior contiene un hisopo para la recolección de la muestra y el tubo contenedor del medio semisólido de Cary Blair.
También en el mercado se dispone de casas comerciales que suministran el medio deshidratado para su preparación en el laboratorio.
Para ello, pese 13,2 gr del medio deshidratado y disuelva en un litro de agua destilada. Caliente y agite la preparación hasta disolver completamente. Distribuya el medio en tubos de ensayo con tapa de rosca (baquelita).
Someta los tubos a vapor de agua por 15 minutos. Dejar enfriar y mantener a temperatura ambiente hasta su uso.
El medio Cary Blair sin inocular puede conservarse en condiciones óptimas hasta por 18 meses a temperatura ambiente.
El pH del medio debe ser ajustado a 8,4 ± 0,2. El color del medio preparado es beige, con cierta opalescencia.
El medio Cary Blair se usa cuando existe la imposibilidad de procesar de forma inmediata las muestras de heces, hisopados rectales e hisopados vaginales.
Cuando no sea posible disponer de un medio de transporte las muestras se pueden conservar a -70 °C.
El hisopo se impregna con la muestra y el mismo se introduce dentro del medio Cary Blair, sin llegar al fondo.
El medio Cary Blair debe poseer una etiqueta en la que se colocan los datos básicos, tales como: nombre y apellido del paciente, número de identificación de la muestra, fuente de la toma de muestra, médico tratante, fecha y hora de la toma de muestra, diagnóstico presuntivo, tratamiento con antibiótico.
Se tapa bien y se transporta a temperatura ambiente en el caso de muestras fecales. En tanto que, para muestras vaginales en busca de microorganismos anaerobios se recomienda transportar las muestras a 4°C.
En todos los casos el tiempo de traslado recomendado es de 4-6 horas, con un máximo de 24 horas.
Si se sospecha de la presencia de Campylobacter jejuni en muestras de heces y estas no pueden ser procesadas en 24 horas, se recomienda la conservación en medio Cary Blair a 4°C.
Diversos estudios han demostrado que el medio Cary Blair puede conservarse viable a microorganismos enteropatógenos del género Shigella y Salmonella hasta por 49 días después de tomada la muestra.
Por su parte, Vibrio cholerae, otro patógeno intestinal de importancia, es capaz de sobrevivir por 22 días, mientras que Yersinia pestis (agente causal de la peste bubónica y neumónica) puede ser recuperada después de 75 días.
Sin embargo, a pesar de la durabilidad demostrada en cuanto a la recuperación de estos microorganismos, se recomienda que las muestras tomadas sean transportadas en el medio Cary Blair al laboratorio lo más rápido posible.
Así mismo, una vez que la muestra llegue al laboratorio, esta debe ser sembrada sin demora en los respectivos medios de cultivos.
Por otra parte, el medio Cary Blair además de ser útil para el transporte de microorganismos facultativos, también es recomendado para muestras que contengan patógenos anaerobios.
En este sentido, DeMarco y colaboradores en el 2017 realizaron un estudio titulado: Supervivencia de microorganismos vaginales en tres sistemas de transporte disponibles comercialmente.
Ellos demostraron que el medio de transporte Cary Blair es el mejor medio de transporte para la conservación y recuperación de microorganismos anaerobios vaginales. Así mismo, demostraron que la mayor tasa de recuperación fue lograda cuando la temperatura del traslado fue de 4°C.
Por tanto, se concluye que la temperatura de transporte para hisopados vaginales (microorganismos anaerobios) debe hacerse a 4°C. Mientras que para muestras fecales en busca de microorganismos facultativos, la temperatura ideal es la ambiental.
Para evaluar el control de calidad del medio de transporte Cary Blair se pueden utilizar cepas conocidas como Shigella sonnei ATCC 11060, Salmonella choleraesuis ATCC 14028, Vibrio cholerae y Campylobacter sp.
Se inocula el medio con la cepa elegida y se mantiene a temperatura ambiente por 24 horas. Luego se siembran en los medios de cultivo correspondientes. En todos los casos se espera una recuperación satisfactoria del microorganismo en cuestión.
- DeMarco AL, Rabe LK, Austin MN, et al. Survival of vaginal microorganisms in three commercially available transport systems. Anaerobe. 2017; 45: 44–49.
- Wasfy M, Oyofo B, Elgindy A, Churilla A. Comparison of preservation media for storage of stool samples. J Clin Microbiol. 1995; 33 (8):2176–2178.
- Dan M, Richardson J, Miliotis MD, Koornhof HJ. Comparison of preservation media and freezing conditions for storage of specimens of faeces. J Med Microbiol. 1989; 28 (2):151-4.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Laboratorios Conda Pronadisa. Medio Cary Blair. Disponible en: condalab.com
- Laboratorio Metrix. Cary Blair. Disponible en: metrixlab.mx
