¿Qué es la cariolisis?
La cariolisis es uno de los cambios que se identifican en los núcleos de las células cuando estas mueren a consecuencia de una noxa o daño externo, como por ejemplo debido a la hipoxia (aporte insuficiente de oxígeno) o sustancias tóxicas.
Su nombre deriva del griego karyon, que significa “núcleo” y lisis, que puede ser interpretado como “atenuación” o disolución”; por tanto el término cariolisis significa literalmente “borramiento del núcleo”.
Este fenómeno se presenta durante la etapa de necrofanerosis, tal como la picnosis y la cariorrexis, pudiendo ser el único cambio nuclear o estar incluido dentro de un continuum que comienza con la picnosis, pasa por la cariorrexis y termina en la cariolisis.
Tal como sucede en la cariorrexis, el cambio nuclear antecede a los cambios citoplasmáticos y el proceso en conjunto se acompaña de inflamación de la matriz extracelular, algo característico de la necrosis y que puede ser considerado una diferencia fundamental con la apoptosis, en la cual no existe el complemento inflamatorio.
La cariolisis ocurre debido a la acción de las enzimas nucleares que en condiciones normales ayudan a desenrollar y fragmentar el ADN a fin de que pueda transcribirse, pero que en condiciones de muerte celular por noxa (necrosis) comienzan a desintegrar el núcleo en su totalidad.
Índice del artículo
- 1 Enzimas nucleares
- 2 Tipos de nucleasas
- 3 Fisiopatología de la cariolisis
- 4 Hallazgos a la microscopía de luz
- 5 Referencias
Las enzimas del núcleo celular son múltiples y muy específicas, siendo vitales para la fisiología del ADN y el ARN.
Tal como se encuentran estructurados los genes y cromosomas formando la cromatina, es virtualmente imposible que se dé la transcripción y replicación del ADN, dado que se trata de una cadena continua, sumamente larga y con una conformación espacial tridimensional muy compleja.
A fin de facilitar el proceso de replicación y transcripción las enzimas nucleares “cortan” el fragmento de ADN a ser transcrito, permitiendo así que el ARN se acople a una cadena lineal de ácido desoxiribonucleico con un inicio y un final muy claro.
También conocidas como “fosfodiesterasas”, las enzimas nucleares son capaces de escindir los enlaces fosfodiéster, piezas clave en la estructura de los ácidos nucleícos, regulando además los niveles intracelulares de AMP y GMP cíclicos.
Según el sitio donde ejercen su efecto las endonucleasas, se clasifican en dos grandes categorías: nucleasas y ligasas.
Hasta ahora se han descrito grosso modo los efectos de las enzimas nucleasas, responsables de “cortar” las piezas de ADN para permitir su replicación, sin embargo una vez que se ha completado la transcripción de un fragmento de ADN, este debe volver a integrarse dentro de la gran hebra de ácido desoxiribonucleico a la cual pertenece y además hacerlo en una posición específica.
Es allí donde entran en juego las “ligasas”, enzimas capaces de “pegar” en su lugar una cadena de ADN previamente escindida por las fosfodiesterasas.
El delicado equilibrio entre las nucleasas y las ligasas permite mantener la integridad del material genético, de manera que cuando la actividad de una enzima supera a la otra se pueden predecir problemas.
A fin de comprender el rol de la fosfodiesterasa en la cariolisis resulta imprescindible conocer los distintos tipos que existen, dado que son las responsables del proceso en su totalidad.
En este sentido las ligasas prácticamente no tienen ningún papel, de hecho su actividad queda anulada siendo imposible revertir el proceso iniciado por las nucleasas.
Así pues, según el sitio donde ejercen su acción las nucleasas se dividen en:
– Endonucleasas
– Exonucleasas
– Endonucleasas de restricción
Además de las enzimas capaces de escindir el ADN (conocidas también como ADNasas), en el núcleo también se encuentran enzimas con la capacidad de “cortar” y modelar segmentos de ARN, siendo estas conocidas como ribonucleasas o ARNasas.
Si bien estas enzimas son importantes en la fisiología normal de la célula, durante el proceso de necrosis juegan un papel secundario.
Las endonucleasas son enzimas capaces de cortar cadenas de ADN lejos de su extremo libre, es decir, son capaces de separar el ADN en cualquier punto de la cadena.
Las endonucleasas pueden cortar el ADN al azar en cualquier región sin que esta coincida con una secuencia de nucleótidos en particular.
Las endonucleasas de restricción son un tipo muy especial de endonucleasas capaces de identificar una secuencia de bases específica a fin de realizar en ese punto específico el corte de la cadena de ADN.
Se clasifican en tres grupos: Tipo I, Tipo II y Tipo III.
Las endonucleasas de restricción Tipo I requieren ATP para funcionar (por tanto consumen energía) y son capaces de escindir hasta 1000 pares de bases a partir de la secuencia de reconocimiento.
Por su parte, la versión más simple de las endonucleasas de restricción es la Tipo II; en un proceso que no requiere energía estas enzimas son capaces de cortar el ADN en longitudes variables a partir de la secuencia de restricción.
Finalmente las endonucleasas de restricción Tipo III en un proceso que también consume energía (ATP) cortan la cadena de ADN en pequeños fragmentos que no superan los 25 pares de bases a partir del punto de reconocimiento (restricción).
Finalmente las exonucleasas son aquellas enzimas capaces de cortar el ADN a partir de un extremo libre de la cadena, es decir, son enzimas especializadas en cadenas de ADN lineales previamente escindidas por las endonucleasas.
Así pues, el término ENDOnucleasa hace referencia a la capacidad de la enzima de cortar la cadena de ADN en su interior (ENDO = adentro), mientras que EXOnucleasa indica que la enzima solo puede cortar el ADN en el extremo libre (EXO = afuera).
La actividad sincronizada y armónica de todas estas enzimas permite los complejos procesos de replicación y transcripción genética; sin embargo durante la necrosis este equilibrio se pierde y el ADN comienza a fragmentarse hasta que no quedan más que sus componentes básicos libres y desorganizados, lo cual es sinónimo de muerte celular.
Conociendo el gran número de enzimas presentes en el núcleo, así como la forma en la que ejercen su función, no es difícil inferir la fisiopatología de la cariolisis.
Todo inicia como una pérdida de la homeostasis entre las enzimas nucleasas y las ligasas, siendo el efecto de estas últimas superado con creces por las primeras; es decir, se destruye más ADN del que se puede reparar.
En primera instancia las endonucleasas cortan una cadena larga de ADN en pequeños fragmentos, los cuales posteriormente son reducidos aún más por otras endonucleasas.
Finalmente los fragmentos más cortos son lisados desde sus extremos por las exonucleasas hasta que no quedan vestigios de material nuclear organizado, el cual fue descompuesto enzimáticamente.
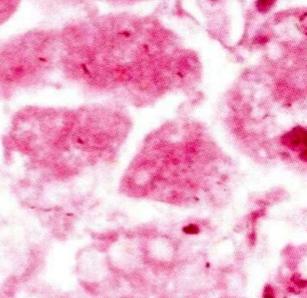
En la microscopía de luz las células que han sufrido cariolisis se ven totalmente rosadas (eosinófilas), siendo imposible identificar material nuclear teñido de morado.
En algunos casos puede verse una mancha evanescente o “fantasma” en el área donde alguna vez estuvo el núcleo de la célula, pero en general el color predominante será el rosado, debido a que ya no quedan estructuras nucleares organizadas capaces de captar la hematoxilina.
- Van Cruchten, S., & Van Den Broeck, W. (2002). Morphological and biochemical aspects of apoptosis, oncosis and necrosis. Anatomia, histologia, embryologia, 31(4), 214-223.
- Parafiniuk, M. (1998). Phenomenon of karyolysis in cytophotomorphometric examinations. In Annales Academiae Medicae Stetinensis (pp. 1-87).
- Tolbert, P. E., Shy, C. M., & Allen, J. W. (1992). Micronuclei and other nuclear anomalies in buccal smears: methods development. Mutation Research/Environmental Mutagenesis and Related Subjects, 271(1), 69-77.
- Levin, S., Bucci, T. J., Cohen, S. M., Fix, A. S., Hardisty, J. F., Legrand, E. K., … & Trump, B. F. (1999). The nomenclature of cell death: recommendations of an ad hoc Committee of the Society of Toxicologic Pathologists. Toxicologic pathology, 27(4), 484-490.
- Zabiti, S. (2002). Alteración de la homeostasis iónica durante la lesión celular inducida por hipoxia metabólica. Papel de los iones monovalentes (Doctoral dissertation, Universidad de Granada).
