Potenciometría: fundamentos, ecuaciones, electrodos
La potenciometría es una técnica de análisis electroquímico que se basa en la medición del voltaje, de un medio o compartimiento, con el cual se determina la actividad o concentración de una especie (iónica o molecular) de interés. Se trata de una técnica no destructiva, pues no busca modificar la naturaleza química del analito en cuestión.
Para llevar a cabo este análisis, es indispensable por lo menos dos electrodos: uno de referencia y otro indicador o de trabajo. Asimismo, debe haber un voltímetro de alta impedancia, con el cual se miden los voltajes sin permitir que haya un flujo de electrones apreciable entre ambos electrodos y las soluciones que les rodean.
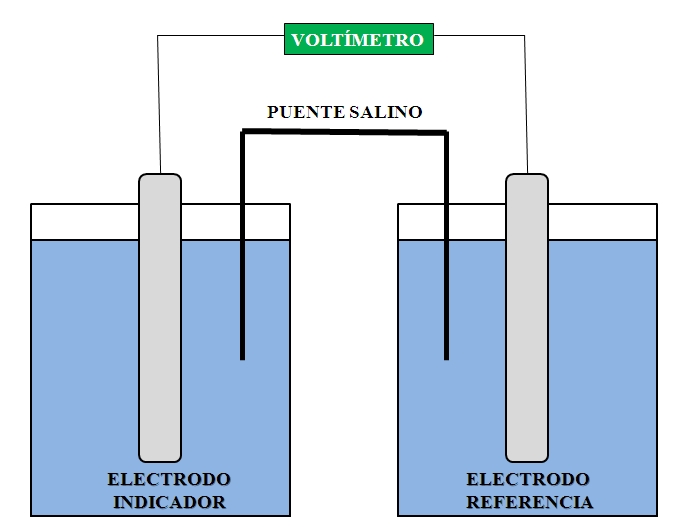
Arriba tenemos una representación general del montaje para un análisis potenciométrico. En el compartimiento donde se introduce el electrodo indicador se encuentra la especie cuya concentración queremos determinar; mientras que en el electrodo de referencia tenemos otra solución, en la cual sí conocemos las concentraciones de sus componentes.
La lectura de voltaje registrada se debe, en principio, a la especie de interés que se aproxima al electrodo indicador. Con este voltaje calculamos la concentración de dicha especie, por ejemplo, la de iones Ca2+, Ag+, H+, Na+, K+, Cl–, etc. La potenciometría tiene usos, por lo tanto, en la química clínica, ambiental, analítica y fisicoquímica.
Índice del artículo
El voltaje que se determina en los análisis potenciométricos es el de la celda, Ecelda, el cual es la diferencia entre los voltajes originados por los dos electrodos, el indicador y el de referencia. Los electrodos son sensibles a las actividades de las moléculas o iones que los rodean, siendo capaces de aceptar electrones de ellos, o por el contrario cedérselos.
Los dos compartimientos están conectados, por lo que fluyen electrones del electrodo donde ocurre la reducción (cátodo), hacia el electrodo donde tiene lugar la oxidación (ánodo).
Sin embargo, esta transferencia de electrones (o corriente) es casi nula, ya que de lo contrario las reacciones redox evolucionarían hasta modificar por completo las concentraciones e identidades de las especies involucradas.
En lugar de eso, el voltímetro apenas permite el paso de los electrones, de tal modo que haya una lectura estable de voltaje, y que la celda pueda alcanzar el equilibrio termodinámico.
Se dice por lo tanto que la potenciometría es una técnica no destructiva, porque pocos iones o moléculas se ven transformados en el proceso de la medición, el cual además es reversible.
El potencial de la celda se relaciona con las actividades o concentraciones de las especies de interés mediante la ecuación de Nernst:
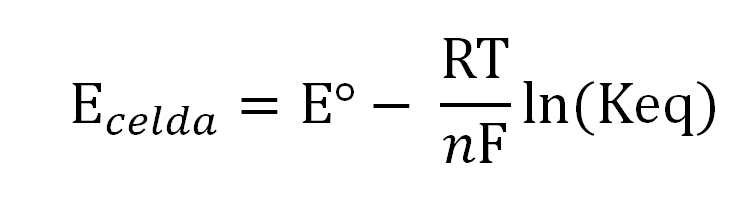
Donde Eº es el potencial de la misma celda en condiciones estándar, F la constante de Faraday, n el número de electrones transferidos, R la constante de los gases, y Keq la constante de equilibrio de la reacción global. Los cálculos se realizan despejando Keq a partir de la lectura de Ecelda, y calculando la concentración deseada de su expresión de equilibrio.
No obstante, conviene calcular las concentraciones por una vía más fácil. Por convención, el potencial de la celda también viene dado por la siguiente ecuación:
Ecelda = Ered– Eox
Donde Ered es el potencial para la semicelda de reducción, en donde se encuentra el electrodo indicador; mientras que Eox es el potencial para la semicelda de oxidación, en donde tenemos el electrodo de referencia. Así, la ecuación puede reescribirse como:
Ecelda = Eindicador – Ereferencia + Ej
Siendo Ej igual al potencial originado por las uniones del puente salino. En la práctica, Ej no puede determinarse, sino asegurarse de que su valor sea lo más mínimo posible utilizando soluciones muy diluidas, o procurando que las composiciones en ambos compartimientos sean parecidas.
De la ecuación anterior podemos calcular Eindicador, el cual es el potencial que realmente nos interesa. Con ese valor, aplicamos nuevamente la ecuación de Nernst:
Eindicador = Eº – (RT/nF) ln(Red/Ox)
Red es la forma reducida del analito o de la especie de interés, y Ox es su forma oxidada. Suponiendo que el analito sean los cationes Zn2+ sobre un electrodo de cinc metálico, tendríamos:
Eindicador = EºZn2+/Zn – (RT/nF) ln (1/aZn2+)
Donde aZn2+ es la actividad del catión Zn2+, la cual por ajustes experimentales se aproxima bastante a su concentración, [Zn2+]. De esta ecuación se despeja la concentración del Zn2+, que como puede verse, afecta directamente el valor de Eindicador.
La forma reducida del cinc, Zn, presenta una actividad igual a 1. Por lo tanto, la ecuación general para cationes oxidados de un metal que actúa como electrodo será igual a:
Eindicador = EºMn+/M – (RT/nF) ln (1/aM+n)
Pero esto solo aplica en el caso de los electrodos de primera especie.
Los electrodos, además del voltímetro, son los elementos más importantes de cualquier análisis potenciométricos. Se mencionarán algunos de ellos a continuación.
Los electrodos de primera especie son metales que se oxidan para originar cationes, conduciendo los electrones hacia el voltímetro. Algunos de estos son los siguientes: Ag, Zn, Cu, Hg, Sn, Tl, Cd y Bi.
No todos los metales sirven como electrodos de primera clase, pues no deben presentar irregularidades cristalinas ni superficies cubiertas por capas de óxido que ocasionen voltajes inestables.
Los electrodos de segunda especie, por otro lado, también son metálicos, pero contienen además una sal sobre su superficie, cuya solubilidad depende de las reacciones redox que tienen lugar. Por ejemplo, los electrodos de Ag-AgCl y Hg-Hg2Cl2 (calomel), son electrodos de segunda especie.
Los electrodos selectivos de iones, también conocidos como de membranas, son aquellos que son sensibles a un ion o molécula en específico, la cual se cuela a través de una membrana diseñada solo para que pase él y no las demás especies en solución.
El ejemplo predilecto de este tipo de electrodo es el de vidrio, construido para determinar la concentración de los iones H3O+ o H+, y así servir como pechímetro.
La potenciometría se ha usado en la química ambiental en la determinación de iones CN–, F– y NO3–, así como de amoníaco en las corrientes de agua.
Los electrodos selectivos son muy útiles cuando la matriz del medio de las mediciones es compleja. Por lo tanto, los demás iones ni moléculas interferirán en las lecturas.
Esta característica es especialmente beneficiosa en las determinaciones potenciométricas realizadas dentro de las mismas células, donde se inyectan microelectrodos para determinar las concentraciones de K+, Na+, Cl–, Ca2+ o H+.
Supóngase que en el medio donde tenemos el electrodo indicador se agrega un titulante que reacciona con el analito y, por ende, modifica su concentración. Entonces ocurrirán cambios en el Ecelda, que corresponderán del mismo modo al cambio de pH en una titulación ácido-base.
Así, graficando Ecelda vs. Vtitulante, podremos determinar el punto de inflexión o de equivalencia, y con ello conoceremos la concentración del analito.
Las titulaciones potenciométricas son muy utilizadas en los laboratorios de química analítica y fisicoquímica. Algunos de los analitos que pueden determinarse con esta técnica son los siguientes: Fe2+, HCO3–, Ca2+, Mg2+, Cu2+, ácido ascórbico, haluros, entre otros.
Todas las titulaciones, en cierta medida, pueden seguirse vía potenciométrica en lugar de recurrir de los indicadores y sus puntos finales.
- Day, R., & Underwood, A. (1986). Química Analítica Cuantitativa (quinta ed.). PEARSON Prentice Hall.
- Skoog D.A., West D.M. (1986). Análisis instrumental. (segunda ed.). Interamericana., México.
- Dr. Doug Stewart. (2020). Definition of Potentiometry. Recuperado de: chemicool.com
- Harvey David. (05 de junio de 2019). Potentiometric Methods. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Encyclopaedia Britannica. (2020). Electrogravimetry. Recuperado de: britannica.com
- Wikipedia. (2020). Electroanalytical methods. Recuperado de: en.wikipedia.org
