Soluciones alcalinas: definición, propiedades y usos
Las soluciones alcalinas se forman cuando se disuelve un álcali en agua. Una solución alcalina se puede sintetizar en el laboratorio y también puede formarse en procesos naturales como por ejemplo la erosión.
Algunos ejemplos de soluciones alcalinas incluyen hidróxido de sodio, hidróxido de potasio, hidróxido de magnesio y carbonato de calcio. Cada una de estas soluciones tiene diferentes aplicaciones en diferentes industrias (What is an Alkali?, S.F.).

Los fabricantes utilizan comúnmente soluciones alcalinas en productos tales como biocombustibles, jabones, medicamentos, detergentes y productos de limpieza, así como en muchas preparaciones alimenticias y aplicaciones especializadas.
Como agentes de limpieza las soluciones alcalinas pueden disolver grasas, aceites y proteínas (ADAMS, 2015).
Índice del artículo
- 1 Bases y álcalis para entender las soluciones alcalinas
- 2 Soluciones alcalinas y su relación con el pH
- 3 Propiedades
- 4 Usos
- 5 Referencias
Base, en química, se refiere a cualquier sustancia que en la solución acuosa es resbaladiza al tacto, sabe amarga, cambia el color de los indicadores (por ejemplo, convierte el papel de tornasol de rojo a azul como ilustra la figura 1), reacciona con ácidos para formar sales y promueve ciertas reacciones químicas.
Ejemplos de bases son los hidróxidos de los metales alcalinos y alcalinotérreos (sodio, calcio, etc.) y las soluciones acuosas de amoníaco o sus derivados orgánicos (aminas).
Tales sustancias producen iones hidróxido (OH-) (Britannica, Base chemical compound, 2010). Existen diferentes tipos de clasificaciones tanto para los ácidos como para las bases:

Según la teoría de Arrhenius, las bases son sustancias que se disocian en el agua para producir átomos o moléculas cargados eléctricamente, llamados iones hidróxido (OH-) (Britannica, Arrhenius theory, 1998).
La teoría de Brønsted-Lowry, también llamada teoría del protón de ácidos y bases, introducida independientemente en 1923 por el químico danés Johannes Nicolaus Brønsted y el químico inglés Thomas Martin Lowry, indica que cualquier compuesto que puede aceptar un protón (H+) de otro compuesto es una base. Por ejemplo en la reacción:
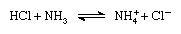
El amoniaco sería una base puesto que acepta protones del ácido clorhídrico (Britannica, Brønsted–Lowry theory, 1998).
La Teoría de Lewis de ácidos y bases introducida en 1923, establece que una base es considerada como cualquier compuesto que posee un par de electrones no compartidos disponibles y es capaz de unirse a una sustancia que sea capaz de aceptarlos (ácido Lewis).
El nitrógeno del amoniaco y el oxígeno en el agua son ejemplos de bases Lewis (Britannica, Lewis theory, 1998).
Los términos “solución básica” y “solución alcalina” se usan a menudo indistintamente, particularmente fuera del contexto de la química.
Álcalis se definen generalmente como un subconjunto de las bases. Es un hidróxido básico o una sal iónica de un elemento de metal alcalino o alcalinotérreo, que es soluble en agua formando una solución alcalina.
Sólo se conocen pocos álcalis, como hidróxido de sodio (NaOH), hidróxido de potasio (KOH), hidróxido de calcio (Ca(OH)2), carbonato de calcio (CaCO3) e hidróxido de magnesio (Mg (OH)2).
Los álcalis excluyen bases como el NH3 o soluciones como hidróxido de amonio, puesto que no están formadas por metales alcalinos o alcalinotérreos.
El potencial del hidrógeno, también conocido como escala de pH, mide el nivel de alcalinidad o acidez de una solución. La escala varía de cero a 14, siendo ácido un pH menor que 7 y básico un pH mayor que 7.
El punto medio 7 representa un pH neutro. Una solución neutra no es ni ácida ni un alcalina. La escala del pH se obtiene en función de la concentración de H+ en la solución.
La escala de pH es logarítmica y, como resultado, cada valor de pH entero por debajo de 7 es diez veces más ácido que el siguiente valor más alto. Por ejemplo, el pH 4 es diez veces más ácido que el pH 5 y 100 veces (10 veces 10) más ácido que el pH 6.
Lo mismo ocurre con valores de pH superiores a 7, cada uno de los cuales es diez veces más alcalino (otra forma de decir básico) que el siguiente valor entero inferior. Por ejemplo, el pH 10 es diez veces más alcalino que el pH 9 y 100 veces (10 veces 10) más alcalino que el pH 8 (pH Scale, S.F.).

Análogamente existe una escala de pOH que se obtiene en función de la concentración de OH y es inversa a la escala de pH (pH, pOH, and the pH scale, S.F.).
Una propiedad característica de las soluciones alcalinas es que, al producir iones OH-, aumenta el pH de una solución a valores mayores que 7 (o disminuyen el pOH a valores menores que 7).
Las siguientes son propiedades que presentan las soluciones alcalinas:
1-Tienen sabor amargo.
2-El papel de tornasol cambia a color azul.
3-Tienen una sensación jabonosa o resbaladiza al tacto.
4-Algunas son corrosivas. Ejemplos, NaOH y KOH.
5-Un álcali menos volátil desplaza un álcali más volátil de su sal. Ejemplo, NaOH (menos volátil) desplaza NH3 (más volátil) a partir deNH4Cl.
NaOH (aq) + NH4Cl (aq) → NaCl (aq) + H2O (l) + NH3 (g)
6-Reaccionan con ácidos para formar sales y agua (reacción de neutralización).
7-Conducen electricidad (es decir, son electrolitos).
8-Muestran valores de pH por encima de 7.
Puesto que los álcalis son bases que son solubles en agua, hacen posible que las propiedades químicas de las bases se utilicen para muchos fines en el laboratorio, la industria y en el hogar, ya que casi todas las reacciones químicas se llevan a cabo en solución.
1-El NaOH se utiliza en la fabricación de papel, jabón y cerámica.
2-Se añade Ca (OH) 2 (cal apagada o simplemente “cal”) a los suelos o lagos para hacerlos menos ácidos.
3-La indigestión suele ser causada por un exceso de HCl en el estómago, pudiendose ser remediado por tabletas de indigestión que contienen una base tal como MgO o CaCO3 para neutralizar el ácido.
4-Los usos industriales incluyen la fabricación de varios productos químicos.
5-Se usan en reacciones de óxido-reducción para establecer el medio básico donde ocurre dicha reacción.
- ADAMS, A. (2015, Junio 17). What is an Alkaline Solution? Tomado de livestrong.com.
- Britannica, T. E. (1998, Diciembre 21). Arrhenius theory. Tomado de britannica.com.
- Britannica, T. E. (1998, Julio 20). Brønsted–Lowry theory. Tomado de britannica.com.
- Britannica, T. E. (1998, Julio 20). Lewis theory. Retrieved from britannica.com.
- Britannica, T. E. (2010, Abril 27). Base chemical compound. Tomado de britannica.com.
- pH Scale. (S.F.). Retrieved fromchemistry.elmhurst.edu.
- pH, pOH, and the pH scale. (S.F.). Tomado de khanacademy.org.
- What is an Alkali? (S.F.). Tomado de freechemistryonline.com.
