Centriolos: Funciones y Características
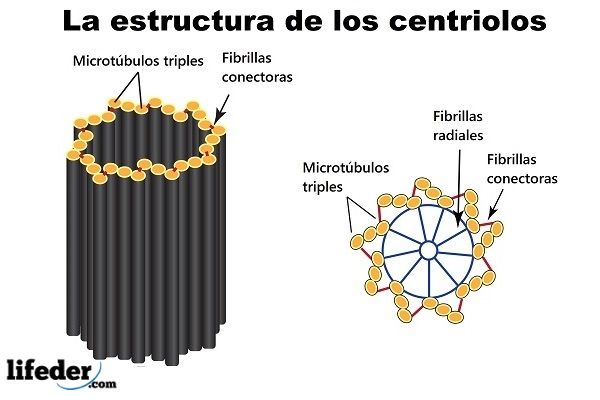
Los centriolos son estructuras celulares cilíndricas compuestas por agrupaciones de microtúbulos. Están formados por la proteína tubulina, que se encuentra en la mayoría de las células eucariotas.
Un par asociado de centríolos, rodeado por una masa informe de material denso llamado material pericentriolar (PCM) compone una estructura llamada centrosoma.
La función de los centriolos es dirigir el ensamblaje de los microtúbulos, participando en la organización celular (posición del núcleo y disposición espacial de la célula), formación y función de flagelos y cilios (ciliogénesis) y división celular (mitosis y meiosis).
Los centriolos se encuentran en las estructuras celulares conocidas como centrosomas de las células animales y están ausentes en las células vegetales.
Los defectos en la estructura o el número de centriolos en cada célula, pueden tener consecuencias considerables para la fisiología de un organismo, produciendo alteraciones en la respuesta al estrés durante la inflamación, infertilidad masculina, enfermedades neurodegenerativas y formación de tumores, entre otras.
Un centriolo es una estructura cilíndrica. Un par de centriolos asociados, rodeados por una masa informe de material denso (llamado “material pericentriolar”, o PCM), forma una estructura compuesta llamada “centrosoma”.
Se consideraban poco importantes hasta hace pocos años, cuando se llegó a la conclusión de que eran las organelas principales en la conducción de la división y duplicación celular (mitosis) en células eucariotas (principalmente en humanos y otros animales).
El centriolo
Nueve tripletes de microtúbulos dispuestos alrededor de una circunferencia (conformando un cilindro hueco corto), son los “bloques de construcción” y la estructura principal de un centriolo.
Durante muchos años fue ignorada la estructura y función de los centriolos, a pesar de que ya para la década de 1880, el centrosoma había sido visualizado mediante microscopía óptica.
Theodor Boveri publicó un trabajo seminal en 1888, describiendo el origen del centrosoma proveniente del esperma después de la fertilización. En su corta comunicación de 1887, Boveri escribió que:
“El centrosoma representa el centro dinámico de la célula; Su división crea los centros de las células hijas formadas, alrededor de las cuales todos los demás componentes celulares se organizan simétricamente … El centrosoma es el verdadero órgano divisor de la célula, él media la división nuclear y celular” (Scheer, 2014: 1). [Traducción del autor].
Poco después de mediados del siglo XX, con el desarrollo de la microscopía electrónica, el comportamiento de los centriolos fue estudiado y explicado por Paul Schafer.
Desafortunadamente, este trabajo fue ignorado debido en gran parte a que el interés de los investigadores comenzaba a centrarse en los hallazgos de Watson y Krick sobre el ADN.
El centrosoma
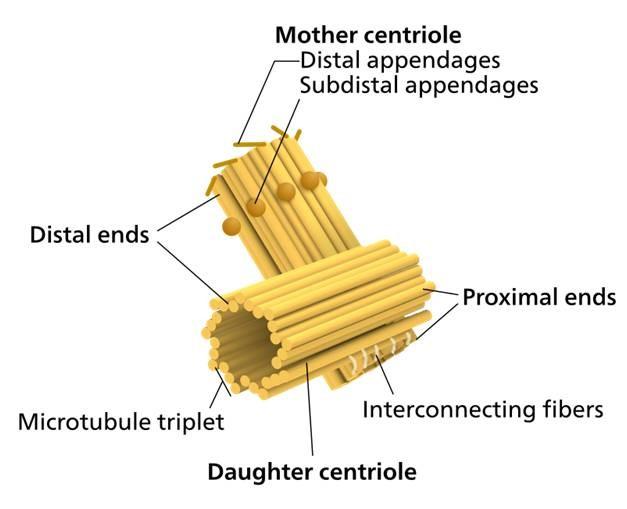
Un par de centriolos, situados adyacentes al núcleo y perpendiculares entre sí, son “un centrosoma”. Uno de los centriolos es conocido como el “padre” (o madre). El otro es conocido como el “hijo” (o hija; es ligeramente más corto, y tiene su base unida a la base de la madre).
Los extremos proximales (en la conexión de los dos centriolos) están sumergidos en una “nube” de proteínas (tal vez hasta 300 o más) conocida como el centro de organización de microtúbulos (MTOC), ya que proporciona la proteína necesaria para la construcción de los microtúbulos.
El MTOC es también conocido como “material pericentriolar”, y tiene carga negativa. De manera inversa, los extremos distales (alejados de la conexión de los dos centriolos) están cargados positivamente.
El par de centriolos, junto con el MTOC circundante, se conocen como el “centrosoma”.
Duplicación del centrosoma
Cuando los centriolos comienzan a duplicarse, el padre y el hijo se separan ligeramente y luego cada centriolo comienza a formar un nuevo centriolo en su base: el padre con un nuevo hijo, y el hijo con un nuevo hijo propio (un “nieto”).
Mientras ocurre la duplicación del centriolo, el ADN del núcleo también se está duplicando y separado. Es decir, la investigación actual demuestra que la duplicación del centriolo y la separación de ADN están, de alguna manera, ligadas.
Duplicación y división celular (mitosis)
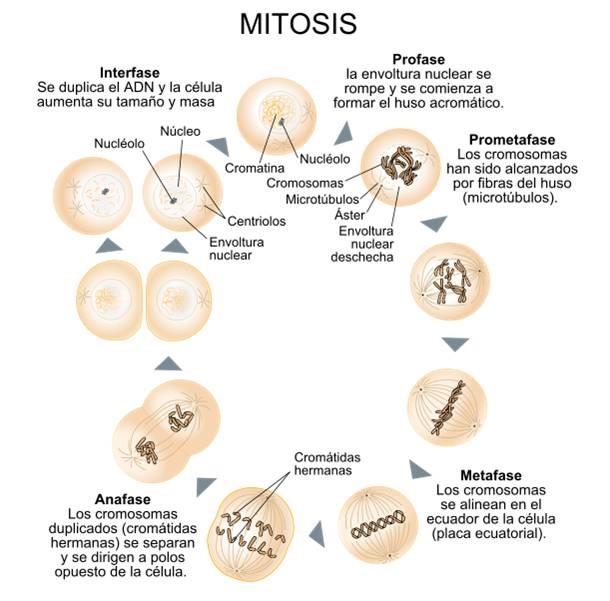
El proceso mitótico se describe con frecuencia en términos de una fase iniciadora, conocida como “interfase”, seguida de cuatro fases de desarrollo.
Durante la interfase, los centriolos se duplican y se separan en dos pares (uno de estos pares comienza a moverse en dirección al lado opuesto del núcleo) y el ADN se divide.
Luego de la duplicación de los centriolos, los microtúbulos de los centriolos se extienden y se alinean a lo largo del eje mayor del núcleo, formando el “huso mitótico”.
En la primera de las cuatro fases de desarrollo (Fase I o “Profase”), los cromosomas se condensan y se acercan, y la membrana nuclear comienza a debilitarse y disolverse. Al mismo tiempo se forma el huso mitótico con los pares de centriolos ahora ubicados en los extremos del huso.
En la segunda fase (Fase II o “Metafase”), las cadenas de los cromosomas se alinean con el eje del huso mitótico.
En la tercera fase (Fase III o “Anafase”), las cadenas cromosómicas se dividen y se mueven hacia los extremos opuestos del huso mitótico, ahora alargado.
Finalmente, en la cuarta fase (Fase IV o “Telofase”), se forman nuevas membranas nucleares alrededor los cromosomas separados, el huso mitótico se deshace y la separación celular comienza a completarse con la mitad del citoplasma que va con cada nuevo núcleo.
En cada extremo del huso mitótico, los pares de centriolos ejercen una importante influencia (aparentemente relacionada a las fuerzas ejercidas a por los campos electromagnéticos generados por las cargas negativas y positivas de sus extremos proximales y distales) durante todo el proceso de división celular.
El centrosoma y la respuesta inmunitaria
La exposición al estrés influye en la función, calidad y duración de la vida de un organismo. El estrés generado, por ejemplo por una infección, pueden llevar a la inflamación de los tejidos infectados, activando en el organismo la respuesta inmunitaria. Esta respuesta, protege al organismo afectado, eliminando al patógeno.
Muchos aspectos de la funcionalidad del sistema inmune son bien conocidos. Sin embargo, los eventos moleculares, estructurales y fisiológicos en los que se encuentra implicado el centrosoma siguen siendo un enigma.
Estudios recientes han descubierto cambios dinámicos inesperados en la estructura, localización y función del centrosoma en diferentes condiciones relacionadas con el estrés. Por ejemplo, tras la imitación de las condiciones de una infección, se ha encontrado un aumento de la producción de PCM y de microtúbulos en células interfásicas.
Los centrosomas en la sinapsis inmunológica
El centrosoma tiene un papel muy importante en estructura y función de la sinapsis inmunológica (SI). Esta estructura está formada por interacciones especializadas entre una célula T y una célula presentadora de antígeno (CPA). Esta interacción célula-célula inicia la migración del centrosoma hacia la SI y su posterior acoplamiento a la membrana plasmática.
El acoplamiento del centrosoma en el SI es similar al observado durante la ciliogénesis. Sin embargo en este caso, no inicia el ensamblaje de los cilios, sino que participa en la organización de la SI y la secreción de vesículas citotóxicas para lisar las células diana, constituyéndose en un órgano clave en la activación de células T.
El centrosoma y el estrés por calor
El centrosoma es blanco de “moleculares chaperonas” (conjunto de proteínas cuya función es ayudar al plegamiento ensamblaje y transporte celular de otras proteínas) que proporcionan protección contra la exposición al choque térmico y el estrés.
Entre los factores de estrés que afectan al centrosoma, se incluyen el daño al ADN y el calor (como el que sufren las células de pacientes febriles). El daño del ADN inicia las vías de reparación del ADN, que pueden afectar la función del centrosoma y la composición de las proteínas.
El estrés generado por el calor provoca modificación de la estructura del centriolo, la disrupción del centrosoma y la inactivación completa de su capacidad para formar microtúbulos, alterando la formación del huso mitótico e impidiendo la mitosis.
La interrupción de la función de los centrosomas durante la fiebre podría ser una reacción adaptativa para inactivar los polos del huso y prevenir la división anormal del ADN durante la mitosis, especialmente dada la potencial disfunción de múltiples proteínas después de la desnaturalización inducida por el calor.
También, podría proporcionar a la célula tiempo extra para recuperar su pool de proteínas funcionales antes de reiniciar la división celular.
Otra consecuencia de la inactivación del centrosoma durante la fiebre es su incapacidad para trasladarse a la IS para organizarla y participar en la secreción de vesículas citotóxicas.
Desarrollo anormal de los centriolos
El desarrollo del centriolo es un proceso es bastante complejo y, aunque en él participan una serie de proteínas reguladoras, pueden ocurrir distintos tipos de fallas.
Si hay un desequilibrio en la proporción de las proteínas, el centriolo hijo puede ser defectuoso, su geometría puede distorsionarse, los ejes de un par pueden desviarse de la perpendicularidad, pueden desarrollarse centriolos hijos múltiples, el centriolo hijo puede alcanzar la longitud completa antes de tiempo, o el desacoplamiento de los pares puede demorarse.
Cuando hay una duplicación equivocada o errónea de centriolos (con defectos geométricos y / o duplicación múltiple), la replicación del ADN se altera, se presenta inestabilidad cromosómica (CIN).
Igualmente, defectos del centrosoma (por ejemplo, un centrosoma agrandado o ampliado) conducen a CIN, y promueven el desarrollo de múltiples centriolos hijos.
Estos errores de desarrollo generan daños en las células que pueden llevarla incluso a malignizarse.
Centriolos anormales y células malignas
Gracias a la intervención de las proteínas reguladoras, al detectarse anomalías en el desarrollo de los centriolos y/o el centrosoma, las células pueden implementar la auto-corrección de las anomalías.
No obstante, de no lograrse la auto-corrección de la anomalía, centriolos anormales o con múltiples hijos (“centriolos supernumerarios”) pueden llevar a la generación de tumores (“tumorigénesis”) o la muerte celular.
Los centriolos supernumerarios tienden a juntarse, llevando a la agrupación del centrosoma (“amplificación del centrosoma”, característico de las células cancerosas), alterando la polaridad celular y el desarrollo normal de la mitosis, lo que resulta en la aparición de tumores.
Las células con centriolos supernumerarios se caracterizan por presentar un exceso de material pericentriolar, interrupción de la estructura cilíndrica o longitud excesiva de los centriolos y centriolos no perpendiculares o mal colocados.
Se ha sugerido que los racimos de centriolos o centrosomas en las células cancerosas podrían servir como un “biomarcador” en el uso de agentes terapéuticos e imaginológicos, como las nanopartículas super-paramagnéticas.
Referencias
- Borisy, G., Heald, R., Howard, J., Janke, C., Musacchio, A., & Nogales, E. (2016). Microtubules: 50 years on from the discovery of tubulin. Nature Reviews Molecular Cell Biology, 17(5), 322-328.
- Buchwalter, R. A., Chen, J. V., Zheng, Y., & Megraw, T. L. Centrosome in Cell Division, Development and Disease. eLS.
- Gambarotto, D., & Basto, R. (2016). Consequences of Numerical Centrosome Defects in Development and Disease. In The Microtubule Cytoskeleton (pp. 117-149). Springer Vienna.
- Huston, R. L. (2016). A Review of Centriole Activity, and Wrongful Activity, during Cell Division. Advances in Bioscience and Biotechnology, 7(03), 169.
- Inaba, K., & Mizuno, K. (2016). Sperm dysfunction and ciliopathy. Reproductive Medicine and Biology, 15(2), 77-94.
- Keeling, J., Tsiokas, L., & Maskey, D. (2016). Cellular mechanisms of ciliary length control. Cells, 5(1), 6.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., Amon, A., Martin, K. C. (2016). Molecular Cell Biology. New York: W. H. Freeman and Company.
- Matamoros, A. J., & Baas, P. W. (2016). Microtubules in health and degenerative disease of the nervous system. Brain Research Bulletin, 126, 217-225.
- Pellegrini, L., Wetzel, A., Grannó, S., Heaton, G., & Harvey, K. (2016). Back to the tubule: microtubule dynamics in Parkinson’s disease. Cellular and Molecular Life Sciences, 1-26.
- Scheer, U. (2014). Historical roots of centrosome research: discovery of Boveri’s microscope slides in Würzburg. Phil. Trans. R. Soc. B, 369(1650), 20130469.
