Derivados halogenados: concepto, propiedades, usos, ejemplos
¿Qué son los derivados halogenados?
Los derivados halogenados son todos los compuestos que poseen un átomo de halógeno; es decir, cualquiera de los elementos del grupo 17 (F, Cl, Br, I). Estos elementos se diferencian del resto por ser más electronegativos, formando una diversidad de haluros inorgánicos y orgánicos.
En la imagen inferior se muestran las moléculas gaseosas de los halógenos. De arriba hacia abajo: flúor (F2), cloro (Cl2), bromo (Br2) y yodo (I2). Cada uno de estos tiene la capacidad de reaccionar con la gran mayoría de los elementos, incluso entre congéneres del mismo grupo (interhalógenos).
Así, los derivados halogenados tienen por fórmula MX si se trata de un haluro metálico, RX si es alquílico y ArX si es aromático. Los dos últimos se ubican en la categoría de haluros orgánicos. La estabilidad de estos compuestos requiere de un “beneficio” energético frente a la molécula gaseosa original.
Por regla general, el flúor forma derivados halogenados más estables que el yodo. La razón se debe a las diferencias entre sus radios atómicos (las esferas moradas son más voluminosas que las amarillas).
Al aumentar el radio atómico, el traslapo de los orbitales entre el halógeno y el otro átomo es más pobre y, por lo tanto, el enlace es más débil.
Nomenclatura
La manera de nombrar correctamente estos compuestos depende de si son inorgánicos u orgánicos.
Inorgánicos
Los haluros metálicos consisten en un enlace, iónico o covalente, entre un halógeno X y un metal M (de los grupos 1 y 2, metales de transición, metales pesados, etc.).
En estos compuestos todos los halógenos tienen un estado de oxidación de -1. ¿Por qué? Porque sus configuraciones de valencia son ns2np5.
Por ende, necesitan ganar solo un electrón para completar el octeto de valencia, mientras que los metales se oxidan, cediéndoles los electrones que disponen.
Así, el flúor queda como F–, fluoruro; el Cl–, cloruro; el Br–, bromuro; y el I–, yoduro. MF se nombraría: fluoruro de (nombre del metal) (n), siendo n la valencia del metal únicamente cuando tenga más de una. Para el caso de los metales de los grupos 1 y 2, no es necesario nombrar la valencia.
Ejemplos
- NaF: fluoruro de sodio.
- CaCl2: cloruro de calcio.
- AgBr: bromuro de plata.
- ZnI2: yoduro de zinc.
- CuCl: cloruro de cobre (I).
- CuCl2: cloruro de cobre (II).
- TiCl4: cloruro de titanio (IV) o tetracloruro de titano.
Sin embargo, el hidrógeno y los elementos no metales —incluso los mismos halógenos— también pueden formar haluros. En estos casos no se nombra al final la valencia del no metal:
- PCl5: pentacloruro de fósforo.
- BF3: trifluoruro de boro.
- AlI3: triyoduro de aluminio.
- HBr: bromuro de hidrógeno.
- IF7: heptafluoruro de yodo.
Orgánicos
Sin importar si sea RX o ArX, el halógeno está enlazado covalentemente a un átomo de carbono. En estos casos se mencionan los halógenos por sus nombres, y el resto de la nomenclatura depende de la estructura molecular de R o Ar.
Para la molécula orgánica más simple, el metano (CH4), se obtienen los siguientes derivados sustituyendo los H por Cl:
- CH3Cl: clorometano.
- CH2Cl2: diclorometano.
- CHCl3: triclorometano (cloroformo).
- CCl4: tetraclorometano (cloruro de carbono (IV) o tetracloruro de carbono).
Aquí R consiste en un solo átomo de carbono. Entonces, para otras cadenas alifáticas (lineales o ramificadas) se cuenta el número de los carbonos desde el que está enlazado al halógeno:
CH3CH2CH2F: 1-fluorpropano.
El ejemplo anterior fue el de un haluro alquílico primario. En el caso de que la cadena esté ramificada, se elige la más larga que contenga el halógeno y se empieza a contar, dejándole a este el menor número posible:
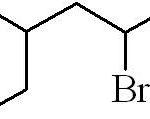
3-metil-5-bromohexano
Del mismo modo ocurre para otros sustituyentes. Asimismo, para los haluros aromáticos se nombra al halógeno y luego el resto de la estructura:
En la imagen superior se muestra el compuesto denominado bromobenceno, resaltando el átomo de bromo en marrón.
Propiedades de los derivados halogenados
Haluros inorgánicos
Los haluros inorgánicos son sólidos iónicos o moleculares, aunque los primeros son más abundantes. Dependiendo de las interacciones y los radios iónicos de MX, este será soluble en agua o en otros solventes menos polares.
Los haluros no metálicos (como los de boro) por lo general son ácidos de Lewis, lo que significa que aceptan electrones para formar complejos. Por otro lado, los haluros (o halogenuros) de hidrógeno disueltos en agua producen lo que se conocen como hidrácidos.
Sus puntos de fusión, ebullición o sublimación recaen sobre las interacciones electrostáticas o covalentes entre el metal o no metal con el halógeno.
Igualmente, los radios iónicos juegan un papel importante en estas propiedades. Por ejemplo, si M+ y X– tienen tamaños similares, sus cristales serán más estables.
Haluros orgánicos
Son polares. ¿Por qué? Porque la diferencia de electronegatividades entre el C y el halógeno crea un momento polar permanente en la molécula. Asimismo, este disminuye conforme se desciende el grupo 17, desde el enlace C–F hasta C–I.
Sin considerar la estructura molecular de R o Ar, los crecientes números de halógenos inciden directamente en los puntos de ebullición, ya que incrementan la masa molar y las interacciones intermoleculares (RC–X—X–CR). La mayoría es inmiscible con el agua, pero pueden disolverse en solventes orgánicos.
Usos de los derivados halogenados
Los usos de los derivados halogenados podrían reservar su propio texto. Los “compañeros” moleculares de los halógenos son un factor clave, dado que sus propiedades y reactividades definen los usos del derivado.
Así, entre la gran diversidad de posibles usos destacan los siguientes:
- Los halógenos moleculares son utilizados para crear bombillas de halógeno, donde se pone en contacto con el filamento incandescente de tungsteno. El propósito de esta mezcla es hacer reaccionar el halógeno X con el tungsteno evaporado. De este modo se evita su deposición en la superficie de la bombilla, garantizándole mayor tiempo de vida.
- Las sales de fluoruros son utilizadas en la fluorización de las aguas y pastas dentales.
- Los hipocloritos de sodio y de calcio son dos agentes activos en las soluciones blanqueadoras comerciales (cloro).
- Pese a que deterioran la capa de ozono, los clorofluorocarbonos (CFCs) son utilizados en los aerosoles y sistemas de refrigeración.
- El cloruro de vinilo (CH2=CHCl) es el monómero del polímero polivinilo de cloruro (PVC). Por otro lado, el teflón, usado como material antiadherente, consiste en cadenas poliméricas de tetrafluoretileno (F2C=CF2).
- Son utilizados en química analítica y en síntesis orgánicas con distintos fines; entre estos, la síntesis de fármacos.
Ejemplos adicionales

La imagen superior ilustra la hormona tiroidea, responsable de la producción de calor así como del aumento del metabolismo general en el organismo. Este compuesto es un ejemplo de un derivado halogenado presente en el cuerpo humano.
Entre otros compuestos halogenados se mencionan los siguientes:
- Diclorodifeniltricloroetano (DDT), eficiente insecticida pero con graves impactos ambientales.
- Cloruro de estaño (SnCl2), usado como agente reductor.
- Cloroetano o 1-cloroetano (CH3CH2Cl), anestésico tópico que actúa rápido enfriando la piel.
- Dicloroetileno (ClCH=CClH) y tetracloroetileno (Cl2C=CCl2), usados como solventes en la industria de limpieza en seco.
