Ciclopentano (C5H10): estructura, propiedades y usos
El ciclopentano se trata de hidrocarburo cíclico, específicamente un cicloalcano. A su vez, es un compuesto orgánico cuya fórmula molecular es C5H10. Puede visualizarse como la versión cerrada del n-pentano, de cadena abierta, en la que sus extremos se han unido mediante la pérdida de dos átomos de hidrógeno.
En la imagen inferior se muestra el esqueleto del ciclopentano. Nótese qué tan geométrico luce su esqueleto, formando un anillo pentagonal. No obstante, su estructura molecular no es plana, sino que presenta dobleces que buscan estabilizar y reducir la tensión dentro del anillo. El ciclopentano es un líquido altamente volátil e inflamable, pero no tanto como el n-pentano.
Debido a su capacidad disolvente, el ciclopentano es uno de los solventes más utilizados en las industrias químicas. No es de extrañarse que muchos productos de olores fuertes lo contengan entre su composición, siendo por tanto inflamables. Asimismo, se usa como agente de expansión para espumas de poliuretano utilizadas en los refrigeradores.
Índice del artículo
- 1 Estructura del ciclipentano
- 2 Propiedades del ciclipentano
- 2.1 Apariencia física
- 2.2 Masa molar
- 2.3 Punto de fusión
- 2.4 Punto de ebullición
- 2.5 Punto de destello
- 2.6 Temperatura de autoignición
- 2.7 Calor de vaporización
- 2.8 Viscosidad
- 2.9 Índice de refracción
- 2.10 Presión de vapor
- 2.11 Densidad
- 2.12 Solubilidad
- 2.13 Coeficiente de partición octanol/agua
- 2.14 Reactividad
- 3 Usos
- 4 Referencias
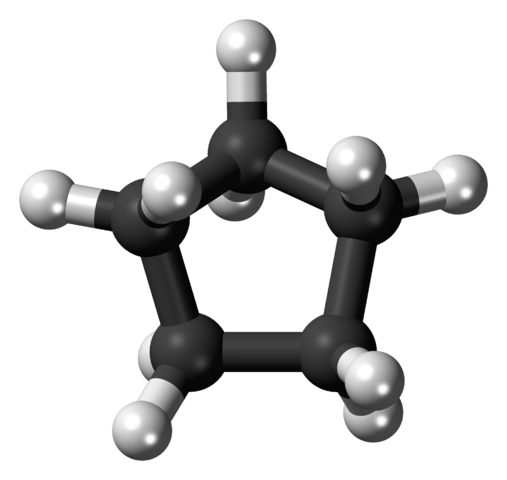
En la primera imagen se mostró el esqueleto del ciclopentano. Arriba ahora vemos que es más que un simple pentágono: en sus bordes sobresalen átomos de hidrógeno (esferas blancas), mientras los átomos de carbono componen el anillo pentagonal (esferas negras).
Al tener solo enlaces C-C y C-H, su momento dipolar es insignificante, por lo que las moléculas de ciclopentano no pueden interaccionar entre ellas mediante fuerzas dipolo-dipolo. En su lugar, se mantienen cohesionadas gracias a las fuerzas dispersivas de London, con los anillos intentando apilarse uno encima del otro.
Este apilamiento ofrece cierta área de contacto mayor que la disponible entre las moléculas lineales de n-pentano. Como resultado de esto, el ciclopentano tiene mayor punto de ebullición que el n-pentano, así como una menor presión de vapor.
Las fuerzas dispersivas son las responsables de que el ciclopentano forme un cristal molecular cuando se congela a -94 ºC. Aunque no haya mucha información respecto a su estructura cristalina, esta es polimórfica y cuenta con tres fases: I, II y III, siendo la fase II una mezcla desordenada de la I y la III.
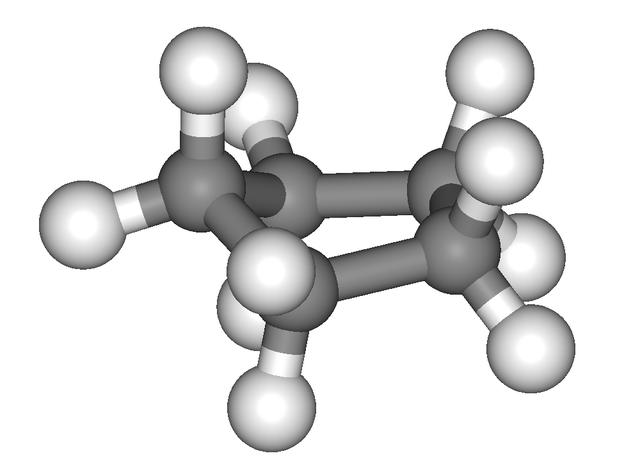
La imagen anterior da la falsa impresión de que el ciclopentano es plano; pero no es así. Todos sus átomos de carbono tienen hibridación sp3, por lo que sus orbitales no se sitúan en un mismo plano. Asimismo, como si esto no fuera suficiente, los átomos de hidrógeno se encuentran muy cercanos entre sí, repeliéndose fuertemente cuando están eclipsados.
Es así pues que se habla de conformaciones, siendo una de ellas la de media silla (imagen superior). Desde esta perspectiva, sí se aprecia claramente que el anillo de ciclopentano presenta dobleces, los cuales ayudan a disminuir su tensión anular a causa de sus átomos de carbono tan próximos entre sí.
Dicha tensión se debe a que los enlaces C-C presentan ángulos menores a 109’5º, el valor ideal para el entorno tetraédrico producto de sus hibridaciones sp3.
No obstante, a pesar de esta tensión, el ciclopentano es un compuesto más estable y menos inflamable que el pentano. Esto puede comprobarse comparando sus rombos de seguridad, en el que la inflamabilidad del ciclopentano tiene 3, mientras que la del pentano, 4.
Líquido incoloro con un olor suave parecido al del petróleo.
70,1 g/mol
-93,9 ºC
49,2 ºC
-37,2 ºC
361 ºC
28,52 kJ/mol a 25 ºC
0,413 mPa·s
1,4065
45 kPa a 20 ºC. Esta presión corresponde alrededor de unas 440 atm, menor sin embargo que la del n-pentano: 57,90 kPa.
Aquí se manifiesta el efecto de la estructura: el anillo del ciclopentano permite interacciones intermoleculares más efectivas, lo cual cohesiona y retiene más sus moléculas en el seno del líquido en comparación a las moléculas lineales del n-pentano. Por ende, este último tiene mayor presión de vapor.
0,751 g/cm3 a 20 ºC. Por otro lado, sus vapores son 2,42 veces más densos que el aire.
En un litro de agua a 25 ºC apenas se disuelven 156 mg de ciclopentano, debido a su carácter hidrofóbico. Sin embargo, es miscible en solventes apolares como otras parafinas, éteres, benceno, tetracloruro de carbono, acetona y etanol.
3
El ciclopentano es estable si se le almacena apropiadamente. No es una sustancia reactiva debido a que sus enlaces C-H ni C-C no son fáciles de romper, aun cuando conllevaría a que se liberara energía causada por la tensión del anillo.
En presencia de oxígeno, arderá en una reacción de combustión, sea esta completa o incompleta. Al ser el ciclopentano un compuesto muy volátil, debe almacenarse en lugares donde no pueda ser expuesto ante ninguna fuente de calor.
Mientras, en ausencia de oxígeno el ciclopentano sufrirá una reacción de pirolisis, descomponiéndose en moléculas más pequeñas e insaturadas. Una de ellas es el 1-penteno, el cual demuestra que el calor rompe el anillo del ciclopentano para originar un alqueno.
Por otro lado, el ciclopentano puede reaccionar con el bromo bajo radiación ultravioleta. De esta manera, se sustituye uno de sus enlaces C-H por C-Br, el cual a su vez puede sustituirse por otros grupos; y así, van surgiendo los derivados de ciclopentano.
El carácter hidrofóbico y apolar del ciclopentano lo vuelve un solvente desengrasante, junto a los otros solventes parafínicos. Debido a esto, suele ser parte de las formulaciones de muchos productos, tales como los pegamentos, resinas sintéticas, pinturas, adhesivos, tabaco y gasolina.
Cuando se somete el ciclopentano a pirolisis, una de las sustancias más importante que genera es el etileno, el cual tiene incontables aplicaciones en el mundo de los polímeros.
Uno de los usos más destacables del ciclopentano es como agente de expansión para la fabricación de espumas aislantes de poliuretano; es decir, los vapores de ciclopentano, a raíz de su gran presión, expanden el material polimérico hasta darle la forma de una espuma con propiedades beneficiosas para utilizarse en el armazón de refrigeradores o congeladores.
Algunas compañías han optado por sustituir los HFCs por ciclopentano en la fabricación de materiales aislantes, ya que no contribuye al deterioro de la capa de ozono, y reduce además la liberación de gas invernadero al medio ambiente.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Wikipedia. (2020). Cyclopentane. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Cyclopentane. PubChem Database, CID=9253. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Cyclopentane. ScienceDirect. Recuperado de: sciencedirect.com
- GE Appliances. (11 de enero de 2011). Reducing greenhouse gas emissions at GE’s refrigerator manufacturing facilities. Recuperado de: pressroom.geappliances.com
