Safranina: características, uso, técnicas, toxicidad
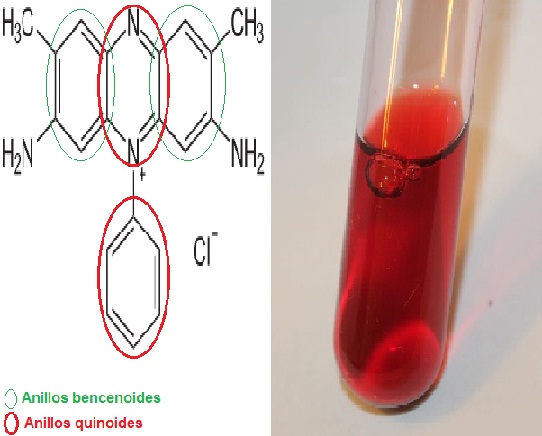
La safranina es un colorante meriquinoide, llamado así por poseer en su estructura química de 2 anillos bencenoides y de 2 anillos quinoides, siendo estos últimos los que proporcionan el color rojo.
También es llamada dimetil safranina o rojo básico 2 en su forma resumida, ya que su nombre científico es 3,7-diamino-2,8-dimetil-5- fenil-fenaziniumcloro dimetil safranina y la fórmula química es C20H19N4 Cl.
Existe una variante denominada trimetil-safranina pero no hay una diferencia significativa entre ambas sustancias.
La safranina es un colorante monocromático y, según las características de la fórmula química, es una sustancia con carga positiva. Por tanto, tiene afinidad con estructuras cargadas negativamente. Estas estructuras serán teñidas de color rojo.
Esta propiedad le confiere aplicabilidad en muchas técnicas histológicas para teñir diversas estructuras celulares, tanto de organismos eucariotas como procariotas.
La safranina es utilizada como colorante de contraste en importantes y conocidas técnicas de uso rutinario en bacteriología. Estas técnicas son: la tinción de Gram-Hucker, la tinción de Schaeffer Fulton para esporas o la tinción de cápsulas bacterianas, entre otras.
Índice del artículo
- 1 Características
- 2 Uso
- 3 Técnicas en el área de bacteriología
- 4 Técnicas en el área de histología
- 5 Toxicidad
- 6 Referencias
El color del azafrán (especia obtenida de los estigmas de la flor de Crocus sativus) fue la inspiración para colocarle el nombre a este colorante. Del término azafrán proviene el nombre de safranina. Eso se debe a la gran similitud entre el color del azafrán y la coloración que brinda este colorante.
La safranina se consigue como cristales o en polvo, siendo ambas presentaciones solubles en agua. El colorante de safranina no posee olor. Tiñe las estructuras de color rojo. Las estructuras que atraen el colorante de safranina se denominan safranófilos.
Estructuralmente la safranina es compleja, posee dos anillo bencenoides a los extremos y en el centro están ubicados los dos anillos quinoides donde se encuentra el catión N+. El centro de la estructura es el sistema encargado de proporcionar el color. Por esta característica este colorante es clasificado dentro de la categoría II.
La safranina se utiliza para teñir diversas estructuras. Especialmente resalta las células de Kulchitsky presentes en el tracto gastrointestinal, llamadas también células enterocromafines.
Es capaz de teñir microorganismos pertenecientes a la familia Rickettsiaceae. Así mismo, se utiliza en diversas técnicas, tales como el método de Koster, un modificado utilizado para la tinción de bacterias del género Brucella.
Por otra parte, la safranina es usada en la técnica de tinción de esporas de Schaeffer Fulton y en la tinción de Gram-Hucker. En ambas técnicas, la safranina funciona como un colorante de contraste.
En la primera las esporas toman el color del verde de malaquita y el resto de las estructuras se tienen de rojo por la safranina. En la segunda, las bacterias Gram negativas pierden el color del cristal violeta en el paso de decoloración, por lo tanto la safranina es quien tiñe a las bacterias Gram negativas de rojo.
Adicionalmente, la safranina se utiliza en bacteriología para preparar medios de agar Brucella con una dilución de safranina 1:5000. Este medio sirve para diferenciar la especie Brucella suis del resto de las especies. Brucella melitensis y Brucella abortus crecen en este medio pero B. suis es inhibida.
En el campo agroindustrial, la safranina ha sido utilizada al 2,25% y diluida 1:10 para teñir muestras de tallo de la planta caña de azúcar.
Esta planta es comúnmente afectada por la bacteria Leifsonia xyli subsp. xyli, quien daña el xilema de la planta. Los tallos teñidos son evaluados para determinar la función de los vasos del xilema.
Un frotis de sangre o tejido se coloca en una solución de buffer (amortiguadora de fosfato pH 7,6). Se deja secar espontáneamente y luego se cubre con azul de metileno durante 3 minutos y se contratiñe con safranina. Las rickettsias se colorean de azul, contrastando con el fondo rojo.
Se realiza un frotis y se flamea en el mechero para su fijación. Posteriormente, se cubre con una mezcla de 2 partes de safranina acuosa saturada con 3 partes de solución de KOH 1 mol/L, durante 1 minuto. Se realiza un lavado con agua destilada y se contratiñe con azul de metileno fenicado al 1%.
Si la muestra contiene bacterias del género Brucella estas se observarán de color naranja en un fondo azul.
Se realiza una mezcla de suspensión bacteriana con tinta china y se le adiciona safranina. Al microscopio se observará un halo rojizo alrededor de cada cápsula bacteriana con un fondo negro.
Se realiza un extendido con la suspensión bacteriana. Luego se fija al calor. Se cubre con verde de malaquita al 5%, flameando frecuentemente hasta la emisión de vapores. Se repite el proceso durante 6-10 minutos. Finalmente, se lava con agua y se contratiñe con safranina al 0,5% por 30 segundos. Los bacilos se tiñen de rojo y las esporas de verde.
Se realiza un extendido con suspensión bacteriana y se fija al calor. Se cubre la lámina con cristal violeta por 1 minuto. Luego se coloca lugol como solución mordiente por 1 minuto. Posteriormente, se decolora con alcohol acetona y finalmente se contratiñe con safranina por 30 segundos.
Las bacterias Gram positivas se tiñen de color violeta azuloso y las bacterias Gram negativas de rojo.
Algunos laboratorios han dejado de usar la técnica de Gram-Hucker para adoptar la técnica modificada de Gram-Kopeloff. En esta última se sustituye la safranina por fucsina básica. Esto es debido a que la safranina tiñe débilmente a especies de los géneros Legionella, Campylobacter y Brucella.
Se tiñen los cortes de tejido del tracto gastrointestinal con cloruro de plata. Luego se decolora con tiosulfato de sodio y finalmente se contratiñe con safranina.
Las células de Kulchitsky se distinguen porque se presentan con gránulos de color pardo negruzco.
La safranina debido a que posee carga positiva se une muy bien a los grupos carboxilos y sulfatos de los glicosaminoglicanos. Estos forman parte de los proteoglicanos que constituyen el cartílago articular. En este sentido, al teñir con safranina O, se puede identificar si hay pérdida o no del cartílago.
La pérdida de tejido cartilaginoso se puede medir a través de la escala de Mankin o también denominada escala de artrosis.
A continuación se explica la técnica: el corte histológico se sumerge en una bandeja con solución de hematoxilina férrica de Weigert, luego se pasa por alcohol ácido y se lava con agua.
Continuar el proceso de coloración sumergiendo la lámina en verde rápido, se lava con ácido acético y ahora se sumerge en safranina O. Para finalizar el proceso se deshidrata utilizando alcoholes a diferentes concentraciones en orden ascendente. El último paso requiere de xileno o xilol para que la muestra se clarifique.
Las láminas se acondicionan con bálsamo de Canadá o similar para ser observadas al microscopio.
Con esta técnica, los núcleos se tiñen de negro, el hueso de verde y el cartílago donde se encuentran los proteoglicanos de rojo.
Pérez y col en el año 2003 propusieron una técnica sencilla y económica para teñir a las macroalgas. Las muestras se preparan en cortes histológicos con parafina. Los cortes se fijan con 1% de glicerina, dejándose secar completamente. Luego se coloca en xilol para eliminar la parafina.
El corte se rehidrata, haciéndolo pasar por una serie de bandejas que contienen etanol en diferentes grados de concentración (orden descendente), durante 2 min en cada una.
Posteriormente, se tiñe por 5 minutos con una mezcla 3:1 de safranina al 1% con azul de toluidina también al 1%, ambos preparados con etanol al 50%. A la mezcla se le adicionan tres gotas de ácido pícrico que actúa como mordiente.
Luego se deshidrata pasando nuevamente por las bandejas de alcoholes, pero esta vez de forma ascendente. Finalmente se aclara con xilol y se prepara la muestra con bálsamo de Canadá para ser observada.
Afortunadamente, la safranina es un colorante que no representa un peligro para quien lo manipula. Es un colorante inocuo, no es cancerígeno y tampoco es inflamable.
Al contacto directo con la piel o mucosas puede causar un ligero enrojecimiento de la zona, sin mayores complicaciones. Para ello se recomienda lavar el área afectada con abundante agua.
- García H. Colorante safranina O. Técnica en salud, 2012; 1 (2): 83-85. Disponible en: medigraphic.com
- Gil M. Tinción de Gram: fundamento, materiales, técnica y usos. 2019. Disponible en: lifeder.com
- Gil M. Tinción de esporas: fundamento, técnicas y usos. 2019. Disponible en: lifeder.com
- Safranina.” Wikipedia, La enciclopedia libre. 7 mar 2017, 10:39 UTC. 3 ago 2019, 20:49 es.wikipedia.org
- Pérez-Cortéz S, Vera B, Sánchez C. Técnica de coloración útil en la interpretación anatómica de Gracilariopsis tenuifrons y Gracilaria chilensis (Rhodophyta). Acta Bot. Venez. 2003; 26 (2):237-244. Disponible en: scielo.org.
- Iglesia Aleika, Peralta Esther Lilia, Alvarez Elba, Milián J, Matos Madyu. Relación de la funcionalidad de los vasos del xilema y la presencia de Leifsonia xyli subsp. xyli.Rev. Protección Veg. 2007; 22 (1): 65-65. Disponible en: scielo.sld
