Samario: características, estructura, obtención, usos
El samario es un elemento químico perteneciente a las tierras raras, específicamente a los lantánidos, y cuyo símbolo es Sm. Su nombre proviene del mineral samarskita, en honor al coronel Vassili Samarsky, quien era un oficial de minería ruso, y que donó muestras de este mineral para su estudio. El químico francés, Paul Émile Lecoq, obtuvo su óxido y algunas de sus sales a partir de la samarskita en 1879, mientras trabajaba en París.
A Lecoq de Boisbaudran se le suele conceder el mérito por el descubrimiento del samario, aunque hubo otros químicos y mineralógicos que previamente trazaron el camino para encontrarlo. No fue hasta 1901 que el químico francés Eugène Anatole consiguió producir la primera muestra pura de samario.

El motivo de esta demora en su aislamiento se debió a que el samario es un metal relativamente reactivo, por lo que no se encuentra puro en la naturaleza, sino formando parte de muchas masas minerales. Asimismo, guarda estrecha relación geológica con otros elementos de tierras raras como el europio y el neodimio, por lo que es difícil separarlo de tales contaminantes.
El samario es un metal con aplicaciones muy diversas, siendo utilizado para medicinas contra el cáncer, datación, reactores nucleares, electrónica, imanes y catálisis orgánicas.
Índice del artículo
- 1 Características del samario
- 2 Estructura química
- 3 Configuración electrónica
- 4 Obtención
- 5 Usos/aplicaciones del samario
- 6 Referencias
El samario posee un brillo blanco plateado, pero que rápidamente se torna dorado (ver imagen superior) debido a que se recubre de una capa de óxido, Sm2O3, el cual recibe el nombre de samaria. Es uno de los metales lantánidos más duros y volátiles, teniendo puntos de fusión y ebullición de 1072 y 1900 ºC, respectivamente.
Se oxida con relativa lentitud cuando está expuesto al aire o sumergido en aceite mineral. Es por eso que debe almacenarse en ampollas, o dentro de recipientes sellados con argón o cualquier otro gas inerte. Cuando se le calienta a 150 ºC, se oxida vigorosamente, despidiendo chispas ardientes si se le lima con dureza.
El samario, al igual que los otros lantánidos, exhibe un estado de oxidación de +3 en casi todos sus compuestos; es decir, se le encuentra como un catión Sm3+. Sin embargo, también es capaz de adoptar el estado de oxidación de +2, Sm2+, encontrándose en compuestos tales como SmO (monóxido de samario), SmS (monosulfuro de samario) y SmI2 (diyoduro de samario).
Se disuelve en agua caliente y sobre todo en ácidos diluidos, como el HCl, H2SO4 y CH3COOH; a excepción del HF, debido a que forma una capa protectora de SmF3 que ralentiza su disolución. Su óxido, Sm2O3, es medianamente básico, por lo que al disolverse en agua liberará cantidades notables de iones OH– por acción del hidróxido Sm(OH)3.
La mayoría de los compuestos de samario +3 se caracterizan por tener colores amarillentos-verdosos, y algunos inclusive destacan por ser luminiscentes.
A temperatura ambiente el samario adopta una estructura cristalina romboédrica, la cual corresponde al polimorfo o fase α. Cuando se le calienta a 731 ºC, ocurre una transición de fase, densificándose sus cristales a una estructura hexagonal compacta (hcp), denominada fase β.
Prosiguiendo el calentamiento a una temperatura de 922 ºC, el samario sufre otra transición a una estructura cúbica centrada en el cuerpo (bcc), llamada fase γ.
Los cristales de samario también pueden sufrir otras transiciones cuando se les comprimen bajo altas presiones, en el orden de los miles de kilobares, siendo la tetragonal y la doble hexagonal compacta (dhcp) algunas de las estructuras obtenidas en estos estudios.
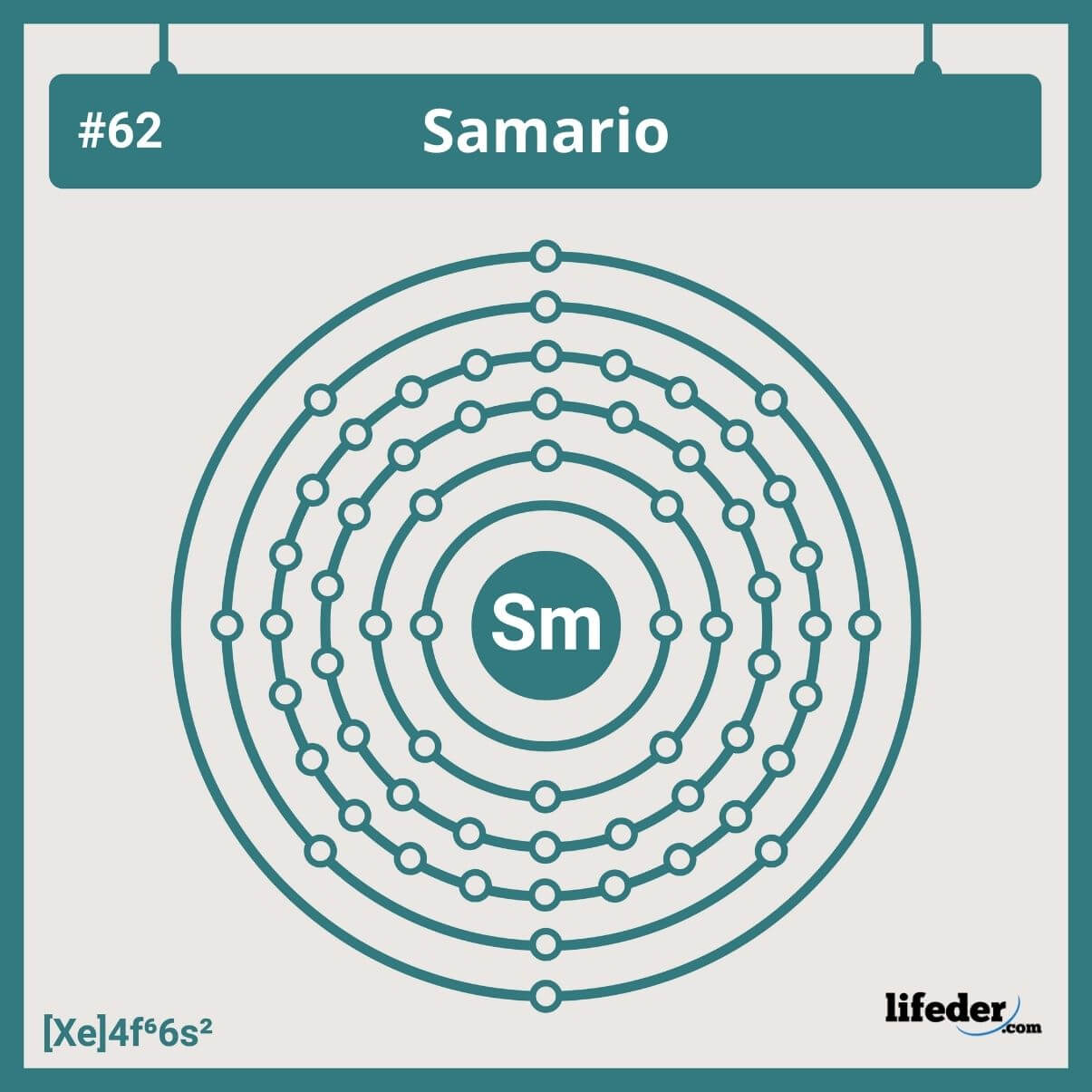
La configuración electrónica abreviada del samario es:
[Xe]6s24f6
Tiene seis electrones en sus orbitales 4f, lo cual concuerda con su posición en el sexto grupo de los lantánidos. Por lo tanto, su configuración electrónica no se trata de ninguna de las tantas desviaciones que vemos en la tabla periódica.

A pesar de ser parte de las tierras raras, la abundancia del samario es superior a la del estaño y otros metales. Se encuentra asociado a óxidos de metales de tierras raras, componiendo éstos minerales como la cerita, la gadolinita, la monazita y la bastnasita, siendo la monazita una de sus principales fuentes mineralógicas, pues contiene alrededor de 2.8% de samario.
Existen varios métodos para obtenerlo. Uno de ellos consiste en procesar las arenas de monazita y separar los iones Sm3+, ya sea mediante disoluciones y posteriores extracciones de solventes, o utilizando cromatografía de intercambio iónico.
Los iones de samario cuando se obtienen como SmCl3, se someten a electrólisis con una mezcla fundida de NaCl o CaCl2. Por otro lado, si estos iones se obtienen como Sm2O3, entonces el óxido se reduce en un crisol de tantalio utilizando lantano, donde se destilan los vapores de samario debido a su menor punto de ebullición. La ecuación para esta reducción es como sigue a continuación:
Sm2O3 + 2La → 2Sm + La2O3
La reducción se lleva a cabo en caliente (cercano a 1400 ºC) y dentro de un horno de inducción al vacío, lo cual agiliza todavía más la destilación de los vapores resultantes de samario.

El samario se alea con el cobalto para dar lugar a las aleaciones SmCo, cuya magnetización es permanente y alrededor de 10000 veces superior que la del hierro.
Estos imanes de samario-cobalto se usan sobre todo en los obturadores de las cámaras, audífonos, motores, pastillas de guitarras eléctricas, así como en aplicaciones militares donde soportan temperaturas superiores a los 400 ºC.
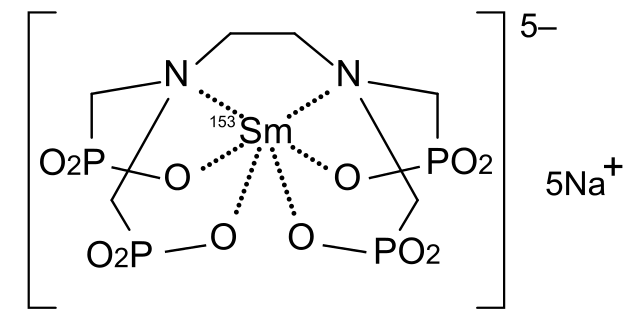
El samario en sí mismo es relativamente tóxico. Sin embargo, uno de sus isótopos radiactivos, el 153Sm, quelado por una molécula de EDTMP (etilendiaminotetrametilenfosfonato, imagen de arriba), sirve para combatir el dolor en el tratamiento de los cánceres de próstata, pulmón y senos. Este medicamento recibe el nombre de samario (153Sm) lexidronam, comercialmente conocido como Quadramet.
El isótopo 149Sm es un excelente absorbente de neutrones, por lo que se utiliza en los reactores nucleares para controlar las reacciones y evitar que haya una explosión.
El SmS convierte la diferencia de temperatura en electricidad, por lo que es usado como termoeléctrico en distintos equipos. Asimismo, tiene la particularidad de tornarse metálico bajo presiones relativamente bajas.
El decaimiento alfa del isótopo 147Sm (t1/2= 1.06×1011) al isótopo 143Nd, es usado para datar muestras de rocas o meteoritos dentro o fuera de la Tierra. Tiene la ventaja de que los átomos 147Sm y 143Nd comparten las mismas características geológicas, es decir, no sufren grandes separaciones durante los procesos metamórficos.
El samario se usa en síntesis orgánicas como SmI2, actuando como agente reductor en numerosas síntesis de versiones sintéticas de productos naturales. Por otro lado, el Sm2O3 es un catalizador de la dehidratación y deshidrogenación del etanol.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Samarium. Recuperado de: en.wikipedia.org
- Oleg D. Neikov, & Stanislav S. (2019). Handbook of Non-Ferrous Metal Powders: Technologies and Applications. (Second edition). ScienceDirect.
- The Editors of Encyclopaedia Britannica. (2020). Samarium. Recuperado de: britannica.com
- National Center for Biotechnology Information. (2020). Samarium. PubChem Element. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2020). Samarium Element Facts. Recuperado de: chemicool.com
- Strekopytov, S. (2016). Salute to samarium. Nature Chem 8, 816. doi.org/10.1038/nchem.2565
