Lince rojo: características, hábitat, reproducción, nutrición
El lince rojo o gato montés mexicano (Lynx rufus) es un mamífero norteamericano de la familia Felidae. Es una de las cuatro especies de linces reconocidas a nivel mundial y una de las menos amenazadas.
Constituye una de las dos especies de linces conocidos en Norteamérica, junto con el lince canadiense Lynx canadensis. Es uno de los felinos más y mejor estudiados en Estados Unidos, sin embargo, muchos aspectos de su biología permanecen desconocidas al sur de su distribución (México).

El lince rojo cuenta con 12 subespecies reconocidas a lo largo de toda su área de distribución entre las que se encuentran L. r. rufus, baileyi, californicus, escuinapae, fasciatus, floridanus, gigas, oaxacensis, pallescens, peninsularis, superiorensis y texensis.
Los linces al igual que gran parte de los felinos, son animales solitarios y con un patrón de actividad diurno y nocturno. Muchos autores indican que el lince es un depredador oportunista, sin embargo, otros afirman que este felino evolucionó como un depredador especializado en la captura de lagomorfos.
A pesar de ser principalmente terrestre, trepan muy bien debido a la presencia de garras retráctiles bien desarrolladas. Las crías y ejemplares juveniles pueden ocultarse sobre los árboles mientras la madre se encuentra cazando.
Los linces rojos establecen territorios que pueden variar de tamaño estacionalmente. Los machos suelen tener un territorio más amplio, solapado con el de varias hembras. Este territorio tiende a ampliarse en la época reproductiva y reducirse en las hembras que tienen crías pequeñas.
Además los cambios del tamaño del territorio son un reflejo del patrón de abundancia de las presas. Los machos pueden cazar animales de mayor tamaño que las hembras debido a la diferencia de tamaños entre sexos. Sin embargo, la selección de presas más pequeñas por parte de las hembras, señala que se alimentan de las presas más abundantes del hábitat.
Índice del artículo
- 1 Características generales
- 2 Hábitat y distribución
- 3 Reproducción
- 4 Nutrición
- 5 Comportamiento
- 6 Referencias
El lince rojo es la especie más pequeña de las cuatro especies de linces conocidos a nivel mundial. Lynx rufus es una especie sexualmente dimórfica, siendo los machos más grandes que las hembras.
Estos felinos pueden alcanzar tallas de hasta 63 cm de alto por 1,6 metros de largo, desde la cabeza hasta la punta de la cola. Pueden pesar en promedio entre 7 y 12 kg, aunque los registros de algunos ejemplares machos sobrepasan los 18 kg.
Su pelaje es pardo rojizo, ligeramente moteado con tonos grises y negros en la región dorsal. En la región lateral es más claro y el moteado disminuye hacia la región ventral que tiene una tonalidad clara con manchas negras dispersas. Esta coloración permite un buen camuflaje con su hábitat natural.
Las extremidades tienen una coloración similar a la región dorsal. Las patas delanteras tienen internamente un par de bandas negras que los distinguen de otras especies del género. Las patas son largas, las orejas son puntiagudas y la cola mide alrededor de 20 centímetros y es bandeada y con la punta negra.
El lince rojo ocupa hábitats bastante contrastantes. En los Estados Unidos ocupan bosques de coníferas y bosques mixtos boreales, bosques de maderas duras de tierras bajas, pantanos costeros en el sureste, y desiertos y matorrales al suroeste. En México pueden ocupar matorrales secos y pastizales, así como ambientes tropicales.
Altitudinalmente, pueden ocupar espacios desde el nivel del mar hasta los 3500 metros de elevación. Los hábitats que ocupan pueden variar desde zonas desérticas como el desierto de Sonora en México, donde son muy comunes, zonas de arbustal (matorral), sabanas, bosques y áreas con praderas.
Aquellos lugares con una alta intervención en la forma de cultivos, son poco empleadas por estos felinos debido a la baja disponibilidad de presas. Por esta razón, son más comunes en áreas con vegetación densa, sobre todo en el sotobosque, en donde establecen zonas de acecho y sus guaridas de escape y cuidado de crías.
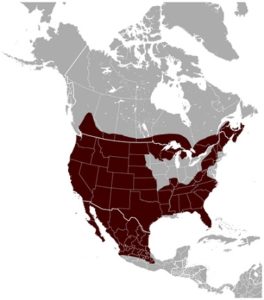
Los linces rojos tienen una distribución amplia en Norteamérica, ocupando desde el sur de Canadá, gran parte de los Estados Unidos hasta el estado de Oaxaca en México que constituye el límite más meridional de su distribución. Es la única especie de lince que ocupa casi toda su distribución histórica en la actualidad.
Su ausencia hacia el sur del istmo de Tehuantepec probablemente se deba a la ausencia de presas y no a la competencia con especies ecológicamente similares. Esta especie parece estar ampliando su distribución al norte, en Canadá, producto de la deforestación de los bosques naturales.
Con la aplicación de cámaras trampa, se ha determinado la presencia de linces rojos más al norte de las montañas rocosas canadienses, lo que ha aumentado más su extensión contrario a lo que se pensaba.
En Estados Unidos, durante el siglo XX, fueron cazados prácticamente hasta su eliminación en los estados de Iowa, Illinois, Indiana, Ohio y Missouri debido a la pérdida y explotación del hábitat. Sin embargo, actualmente las poblaciones en estos estados se están recuperando.
Parte de su distribución al norte se solapa con otra especie de lince más grande, Lynx canadensis.
Las tendencias poblacionales de esta especie son estables, sin embargo, algunas presiones regionalizadas pueden ser un reto para su conservación.
Esta especie es incluida en el apéndice II del CITES debido a su comercio. En las últimas 2 décadas, ha sido el felino más comercializado por sus pieles.
La caza para el comercio ilegal de las pieles, la pérdida de hábitats atribuida al crecimiento de las zonas urbanizadas y las actividades de deforestación son las principales amenazas en el futuro.
Por otro lado, también son vulnerables al consumir roedores envenenados en las ciudades y al aislamiento genético causado por la ruptura en la continuidad de los hábitats.
Los linces frecuentan muy poco los hábitats perturbados, por lo que es muy poco común observarlos fuera de los ecosistemas naturales. En algunas zonas como Florida han disminuido fuertemente sus poblaciones debido al efecto causado por la introducción de especies exóticas como las pitones de Birmania.
Los conflictos con animales domésticos como perros y gatos también constituyen una fuente de amenaza. Además son propensos a la transmisión de enfermedades en algunas poblaciones al este de Canadá, y al atropellamiento cuando usan las carreteras como zonas de paso.
Los machos de esta especie se reproducen con varias hembras y en la temporada reproductiva suelen ampliar su rango de movimiento territorial. De esta manera aumentan las probabilidades de reproducirse con las hembras que tienen territorios que se solapan con el suyo.
Los machos muestran una reducción estacional en la actividad espermatogénica durante el verano y principios del otoño, pero este patrón se ve reducido en machos maduros.
La temporada de apareamiento varía conforme cambia la altitud, longitud, latitud y las variaciones climáticas. Los eventos reproductivos pueden ocurrir durante todo el año, sin embargo, existe un pico desde agosto hasta diciembre.
La hembra en la etapa de proestro comienza a marcar con su orina lugares estratégicos para ser detectadas por los machos. La mayoría de los nacimientos ocurre entre abril y mayo. Algunas hembras que se reproducen de manera temprana, pueden tener una segunda camada al final del año.
Las camadas pueden variar entre 2 y 6 cachorros que generalmente permanecen resguardados en sus guaridas hasta los tres meses de edad. La lactancia puede durar entre dos y tres meses. Las hembras cuidan a sus crías solas hasta que adquieren las habilidades para cazar de manera independiente y delimitar su propio territorio.

Los linces rojos tienen una dieta bastante variada, consistiendo principalmente en conejos y otros roedores pequeños, pero siendo menos especialistas que otras especies de linces como Lynx canadenses.
La selección de las presas que consume este felino depende en gran medida de la disponibilidad temporal que estas tengan en los territorios que ocupan.
Los lagomorfos comprenden en muchas de las localidades que ocupan, más del 70% de la dieta. La presencia de conejos es fundamental para que se establezca una población viable de linces rojos. Entre las especies de lagomorfos más consumidas se encuentran Lepus sp, Romerolagus diazi, Sylvilagus audubonii, S. cunicularius, S. floridanus.
Además, los linces pueden incluir más de 20 especies adicionales en su dieta. Entre estas se incluyen una gran variedad de pequeños roedores terrestres y una gran diversidad de especies de ardillas.
Los machos pueden capturar presas de gran tamaño entre las que se incluyen ungulados juveniles como venados del género Odocoileus y otros mamíferos medianos entre los que se incluyen zarigüeyas, mustélidos, prociónidos y puercoespines.
Además pueden capturar ocasionalmente, cuando los recursos son limitados, varias especies de aves y reptiles como lagartijas y serpientes. Por otro lado, pueden cazar mascotas como perros, gatos y animales de cría.
Estos animales en general tienen un comportamiento escurridizo. Debido a esto, gran parte de la información ecológica recolectada para este animal se ha realizado a partir de herramientas como la telemetría y el estudio de animales muertos por la cacería deportiva.
Los linces machos establecen territorios hasta 1,65 veces más grandes que los de las hembras. Los territorios de las hembras comprenden desde casi 1 a 43 km2 mientras que los machos ocupan desde 3 hasta casi 168 km2 con una media de 39,7 Km2. Para proteger su territorio marcan los árboles con sus garras o con deposiciones de heces y orina.
Las hembras y machos expanden y contraen su territorio en función de la estacionalidad, siendo los territorios más amplios en ambos sexos durante la estación de invierno. Los machos ocupan durante el invierno territorios considerablemente más grandes.
Las densidades de estos felinos varían de acuerdo al área que ocupan. Tienden a verse favorecidos en zonas de media montaña, con alta cobertura de matorrales y zonas empinadas con abundancia de coníferas.
Por otro lado, durante el invierno, este felino tiende a ocupar zonas donde las capas de nieve no son tan gruesas. Durante esta estación, suelen verse más frecuentemente en zonas despejadas como las carreteras, acantilados y plantaciones forestales de abetos en las que se ha contabiliza un mayor número de indicios de presas disponibles.

La orina de estos felinos tiene un alto contenido de compuestos con azufre resultando altamente efectiva en la modificación del comportamiento alimentario de sus presas.
Estos compuestos semioquímicos repelen a animales como Odocoileus hemionus, Odocoileus virginianus, Lepus americanus y Marmota monax evitando que causen daños en plantaciones agroforestales.
También el pulverizado de la orina en árboles y rocas indica el estado de salud, la condición reproductiva y su presencia ante otros ejemplares. Este tipo de señales olfativas constituyen el principal mecanismo de comunicación.
Adicionalmente, han sido observados frotando su pelaje contra la corteza de los árboles y emitiendo vocalizaciones. Estos últimos aspectos de su comportamiento permanecen poco estudiados.
- Allen, M. L., Wallace, C. F., & Wilmers, C. C. (2015). Patterns in bobcat (Lynx rufus) scent marking and communication behaviors. Journal of ethology, 33(1), 9-14.
- Aranda, M., Rosas, O., Ríos, J. D. J., & García, N. (2002). Análisis comparativo de la alimentación del gato montés (Lynx rufus) en dos diferentes ambientes de México. Acta zoológica mexicana, (87), 99-109.
- Chamberlain, M. J., Leopold, B. D., & Conner, L. M. (2003). Space use, movements and habitat selection of adult bobcats (Lynx rufus) in central Mississippi. The American Midland Naturalist, 149(2), 395-406.
- Fritts, S. H., & Sealander, J. A. (1978). Diets of bobcats in Arkansas with special reference to age and sex differences. The Journal of Wildlife Management, 533-539.
- Fritts, S. H., & Sealander, J. A. (1978). Reproductive biology and population characteristics of bobcats (Lynx rufus) in Arkansas. Journal of Mammalogy, 59(2), 347-353.
- Gañán, N., González, R., Sestelo, A., Garde, J. J., Sánchez, I., Aguilar, J. M., … & Roldan, E. R. S. (2009). Male reproductive traits, semen cryopreservation, and heterologous in vitro fertilization in the bobcat (Lynx rufus). Theriogenology, 72(3), 341-352.
- Kelly, M., Morin, D. & Lopez-Gonzalez, C.A. 2016. Lynx rufus . The IUCN Red List of Threatened Species 2016: e.T12521A50655874. http://dx.doi.org/10.2305/IUCN.UK.2016-1.RLTS.T12521A50655874.en. Downloaded on 25 December 2019.
- Lovallo, M. J., & Anderson, E. M. (1996). Bobcat (Lynx rufus) home range size and habitat use in northwest Wisconsin. American Midland Naturalist, 241-252.
- Mattina, M. J. I., Pignatello, J. J., & Swihart, R. K. (1991). Identification of volatile components of bobcat (Lynx rufus) urine. Journal of chemical ecology, 17(2), 451-462.
- McLEAN, M. L., McCAY, T. S., & Lovallo, M. J. (2005). Influence of age, sex and time of year on diet of the bobcat (Lynx rufus) in Pennsylvania. The American midland naturalist, 153(2), 450-454.
- McCord, C. M. (1974). Selection of winter habitat by bobcats (Lynx rufus) on the Quabbin Reservation, Massachusetts. Journal of Mammalogy, 55(2), 428-437.
- Parker, G. R., & Smith, G. E. J. (1983). Sex-and age-specific reproductive and physical parameters of the bobcat (Lynx rufus) on Cape Breton Island, Nova Scotia. Canadian Journal of Zoology, 61(8), 1771-1782.
- Valencia-Herverth, R., & Valencia-Herverth, J. (2012). Presencia del gato montés (Lynx rufus) en selvas tropicales del estado de Hidalgo, México. Therya, 3(1), 81-85.
- Winegarner, C. E., & Winegarner, M. S. (1982). Reproductive history of a bobcat. Journal of Mammalogy, 63(4), 680-682.
