¿Cómo complementa el modelo de Brönsted-Lowry al modelo de Arrhenius?
¿Qué son los modelos de Brönsted-Lowry y de Arrhenius?
Tanto el modelo de Arrhenius como el de Brönsted-Lowry describen dos clases de sustancias muy importantes: ácidos y bases. Ambas participan en los procesos biológicos y forman parte de medicamentos y compuestos útiles.
Los ácidos tienen un característico sabor agrio, mientras que las bases se sienten jabonosas al tacto. Durante largo tiempo, estas diferencias sensoriales eran las que ayudaban a distinguirlos, hasta que el químico sueco Svante Arrhenius (1859-1927), a finales del siglo XIX, estableció cuantitativamente la distinción.
El modelo de Arrhenius de ácido-base afirma que una sustancia es:
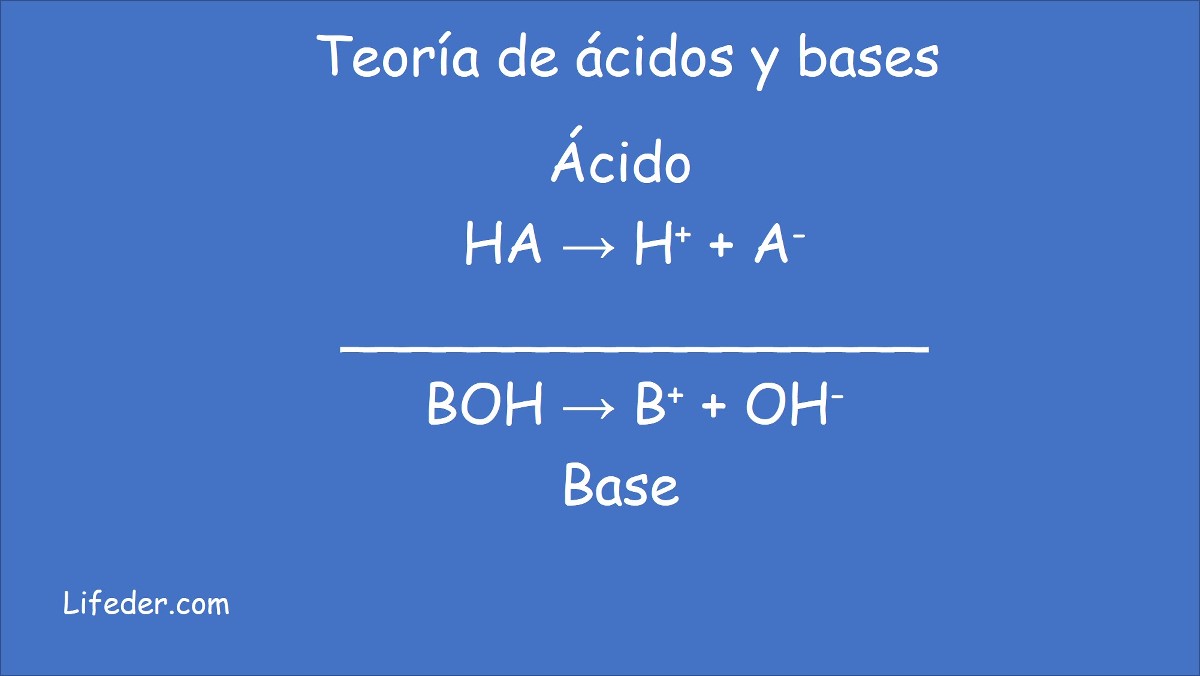
- Ácido, si libera protones (iones hidrógeno H+) o bien iones hidronio H3O+ en solución acuosa.
- Base, cuando produce iones hidróxido (OH−), asimismo en solución acuosa.
Esta definición se limita solo a las soluciones acuosas. Por ello no explica cómo otras sustancias también se comportan como ácidos o bases, aun sin estar disueltas en agua o no contienen iones hidrógeno o hidróxido.
De allí que dos químicos, uno danés, llamado Johannes Brönsted (1879-1949) y otro inglés, Thomas Lowry (1874-1936), ampliaron de manera independiente las definiciones de Arrhenius, para incluir casos no contemplados por este.
Conforme a la nueva teoría, la definición de ácidos y bases es la siguiente:
- Ácido es cualquier especie química que cede protones (iones hidrógeno H+) a otra sustancia.
- Base, especie química que acepta protones (iones hidrógeno H+) de otra sustancia.

El modelo de Arrhenius
En su tesis doctoral, Svante Arrhenius elaboró una teoría acerca de la disociación electrolítica. De acuerdo con esto, existen sustancias que exhiben conductividad eléctrica cuando están en una disolución acuosa, es decir, conducen la electricidad.
Estas sustancias son los electrolitos. Ejemplo de ellas es la sal común, o cloruro de sodio, disuelta en agua, la cual produce iones (especies químicas con carga neta) en la solución.
En el caso del cloruro de sodio NaCl en agua, la correspondiente reacción es:
NaCl → Na+ + Cl−
De igual forma, para una base como el hidróxido de sodio NaOH, en solución acuosa, la disociación electrolítica es:
NaOH → Na+ + OH−
Y para un ácido, asimismo en solución acuosa, como el ácido clorhídrico HCl, se tiene:
HCl → Cl− + H+
El comportamiento de los electrolitos en solución acuosa llevó a Arrhenius a clasificar como ácido a las sustancias que, al ser disueltas en agua, liberan protones, y como bases, a las que liberan iones OH−. Por ello se denominan, respectivamente, ácidos y bases de Arrhenius.
La ventaja de esta teoría se pone de manifiesto en las reacciones de neutralización, en las que se combinan un ácido y una base de Arrhenius. En el proceso desaparecen los iones característicos de cada tipo de sustancia, H+ en los ácidos y OH– en las bases, los cuales producen agua.
Por ejemplo, la mezcla de una disolución acuosa de ácido clorhídrico HCl con una de hidróxido de sodio NaOH, es un ejemplo típico de reacción de neutralización:
HCl + NaOH → NaCl + H2O
La reacción entre un ácido y una base de Arrhenius, produce una sal más agua, originada por la reacción entre los iones H+ y OH−.
Limitaciones del modelo de Arrhenius
El modelo de Arrhenius fue innovador por ser el primero en ofrecer una definición cuantitativa de ácido y de base.
Anteriormente, la distinción entre uno y otro tipo de sustancia debía hacerse con ayuda de los sentidos: si una sustancia es amarga, como el jugo de limón o el vinagre, se trata de un ácido; si es resbaladiza o jabonosa, es una base.
Arrhenius estableció que los ácidos contienen hidrógeno que, al disolverse en agua, aumentan la concentración de iones hidrógeno o protones del agua pura. En cambio, al disolver una base, aumenta la concentración de iones OH−.
Sin embargo, el modelo tiene importantes limitaciones:
-El concepto de ácido y base se aplica únicamente en soluciones acuosas, pero se sabe que hay otras sustancias capaces de comportarse como uno u otra, aun en ausencia de agua.
-Existen ácidos que no contienen hidrógeno (por ejemplo, CO2 y SO3) y bases sin iones hidróxido (como el amoníaco).
-En la práctica, los iones hidrógeno o protones, cargados positivamente, no permanecen libres en la solución. Ellos atraen eléctricamente a las moléculas de agua, que son polares, originando los iones hidronio H3O+.
El modelo de Brönsted-Lowry
Las limitaciones del modelo ácido-base de Arrhenius hicieron necesario ampliar los conceptos. Por ello, hacia 1923, Johannes Brönsted y Thomas Lowry convinieron, de forma independiente y casi al mismo tiempo, que el carácter ácido o básico de una sustancia viene dado por su capacidad de ceder o aceptar protones.
De esta forma, las reacciones de neutralización consisten simplemente en transferencia de protones entre el ácido y la base. El primero es capaz de donar protones, y el segundo está listo para aceptarlos.

Esquemáticamente, la reacción de neutralización quedaría así:
Ácido1 + Base2 → Ácido2 + Base1
Ácidos y bases de Brönsted-Lowry
Comparando la definición de ácido dada por cada modelo, se concluye que los ácidos de Arrhenius también son ácidos de Brönsted-Lowry. Pero se recordará que hay sustancias, como el amoníaco, que disueltas en agua se comportan como base, aun sin disponer de iones hidróxido.
Con la definición de Brönsted-Lowry, el comportamiento básico del amoníaco en agua se explica porque la molécula de amoníaco NH3 acepta un ion H+ del agua, y esta se comporta a su vez como ácido de Brönsted-Lowry.
La reacción del amoníaco y el agua, en solución acuosa, es:
NH3 + H2O ⇔ NH4+ + OH−
La doble flecha significa que la reacción tiene carácter reversible.
De esta forma, el modelo de Brönsted-Lowry complementa al de Arrhenius, incluyendo casos que este, originalmente, no contemplaba.
Sustancias anfóteras
El agua se comporta como ácido de Brönsted-Lowry cuando reacciona con una solución de amoníaco, pero también es capaz de comportarse como base de Brönsted-Lowry, como en la siguiente reacción, entre ácido clorhídrico y agua:
HCl + H2O → H3O+ + Cl−
Cuando una sustancia tiene un comportamiento dual, es decir, que puede ser ácido o base según el compuesto con el que reacciona, se denomina anfótera.
Otras sustancias anfóteras, además del agua, son el ion bicarbonato y los aminoácidos.
Referencias
- Ácidos y bases. Recuperado de: fq.iespm.es.
- Atkins, P. (2007). Principios de Química. 3ra. Edición. Editorial Médica Panamericana.
- Chang, R. (2013). Química. 11va. Edición. McGraw Hill.
- Khan Academy. Ácidos y Bases de Bronsted-Lowry.
- Ripoll, E. Ácidos y bases. Proyecto Descartes. Recuperado de: proyectodescartes.org.
