Precipitado: concepto, reacción, tipos, ejemplos

¿Qué es un precipitado?
Un precipitado es un sólido que se forma a partir de una solución, bien sea por la cristalización de una sustancia disuelta o por la formación de una sustancia insoluble a través de una reacción química.
El primer caso ocurre cuando una sustancia sólida, que inicialmente se encontraba disuelta en un solvente como el agua, se vuelve menos soluble. Esto puede ocurrir cuando:
- La temperatura de la solución se disminuye.
- Se agrega algún agente precipitante.
- Se agrega otro solvente en el que el sólido sea menos soluble.
Cuando su solubilidad se hace menor que su concentración, la solución se vuelve sobresaturada y ocurre una reacción de precipitación.
El segundo caso ocurre luego de cualquier reacción química que genere un producto insoluble o muy poco soluble en el solvente. Una vez comienza a formarse dicho producto, la solución rápidamente se satura y el sólido comienza a precipitar.
Reacción química de precipitación
La reacción de precipitación es el proceso químico que lleva a la formación de un precipitado. Dependiendo de cómo se forme el precipitado, la reacción puede escribirse de dos formas distintas:
- Si la precipitación ocurre porque se disminuyó la solubilidad del sólido en el solvente (enfriando o añadiendo otro solvente, por ejemplo), entonces la reacción de precipitación solo involucra al soluto y se vería así:

Por ejemplo, si se disuelve acetato de sodio (CH3COONa) en agua caliente y luego se deja enfriar, el acetato de sodio precipitará según la siguiente ecuación:

- Si la precipitación ocurre porque se añadió un agente precipitante, entonces la reacción de precipitación involucrará tanto al soluto como al agente precipitante.
Por ejemplo, los iones plata (Ag+) se pueden precipitar de una solución de nitrato de plata (AgNO3) añadiendo una solución de cloruro de sodio o NaCl (agente precipitante). La reacción de precipitación en este caso viene dada por:
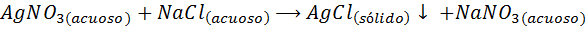
Mecanismo de precipitación
Independientemente de cuál sea la reacción de precipitación, la formación del precipitado siempre ocurre en dos etapas denominadas nucleación y crecimiento:
Nucleación
Al principio de la reacción de precipitación se forman pequeñas partículas de precipitado que se denominan núcleos por lo que a esta etapa se le llama nucleación.
Crecimiento
Luego de la nucleación ya no se forman partículas nuevas, sino que los núcleos ya formados comienzan a crecer hasta que la precipitación se detiene.
Tipos de precipitado
La velocidad con la que se forman los precipitados afecta el tamaño de las partículas del sólido y las propiedades del mismo. Dependiendo del tamaño de las partículas y de la naturaleza del compuesto que está precipitando, se pueden distinguir tres tipos de precipitados:
Precipitados cristalinos
Es el tipo más simple de precipitado. En este caso, el precipitado está formado por partículas sólidas grandes con un diámetro mayor que 0,1 micrómetros.

Los precipitados cristalinos se forman cuando la reacción de precipitación ocurre lentamente. Esto permite que se formen pocas partículas de sólido durante la nucleación, y cada una de estas partículas tiene suficiente tiempo para crecer y formar cristales grandes y pesados que caen al fondo de la solución.
Estas partículas casi siempre son sólidos cristalinos con caras planas y brillantes, similares a las facetas de un diamante, y casi siempre se pueden distinguir a simple vista.
Precipitados caseosos
Son precipitados formados por partículas mucho más pequeñas, de entre 0,01 y 0,1 micrómetros de diámetro. Este tipo de precipitados se forma cuando la reacción de precipitación ocurre muy rápidamente, generando muchas partículas durante la nucleación las cuales no tienen tiempo de crecer.
Por su tamaño, estas partículas son muy livianas y quedan suspendidas en la solución formando un coloide estable. Por esta razón, no sedimentan en el fondo de la solución y esta se ve turbia en lugar de transparente.

Además de esto, las partículas son tan pequeñas que logran atravesar la mayoría de los filtros que se utilizan para separar los precipitados de las soluciones.
Precipitados gelatinosos
Cuando las partículas son aún más pequeñas que las de los precipitados caseosos, es decir con diámetros menores que 0,01 micrómetros, los precipitados se denominan gelatinosos. La razón es porque el sólido adquiere un aspecto similar a la gelatina o a una mermelada.
Estos precipitados también se consideran coloides. De hecho, la gelatina es un ejemplo típico de un coloide, y estos precipitados toman su nombre de la misma.
Ejemplos característicos de precipitados gelatinosos son los óxidos hidratados de algunos metales. Estos óxidos absorben una gran cantidad de agua en su superficie lo que le impide formar partículas más grandes que cristalicen.
Ejemplos de precipitados
Acetato de sodio (CH3COONa)
Como se mencionó anteriormente, el acetato de sodio se puede precipitar a partir de una solución saturada caliente la cual se deja enfriar. Si se deja enfriar lentamente, se forma un precipitado cristalino en la que se observan cristales blancos largos en forma de agujas.
Sulfuro de Cadmio (II) (CdS)
El sulfuro de cadmio es una sal muy insoluble que se forma inmediatamente al mezclar en una solución iones cadmio (II) con otra que contenga iones sulfuro.
Sulfato de cobre (II) pentahidratado (CuSO4.5H2O)
Al disolverlo en agua, el sulfato de cobre (II) forma iones hidratados de color azul intenso. Si se evapora el agua lentamente, precipitan hermosos cristales azules de CuSO4.5H2O. Estos cristales parecen piedras preciosas.
Bromuro de plata (AgBr)
Este es un ejemplo de un compuesto que precipita muy rápido formando un precipitado con partículas muy finas que son difíciles de filtrar.
Óxido hidratado de aluminio (III) (Al2O3.nH2O)
Este es un ejemplo clásico de la formación de un precipitado gelatinoso. Se forma cuando se alcaliniza con hidróxido de sodio (NaOH) una solución de nitrato de aluminio (Al(NO3)3).
Sulfuro de manganeso (II) (MnS)
Muchos sulfuros son insolubles en agua y el sulfuro de manganeso no es la excepción. Este precipita en forma de un polvo muy fino.
Cloruro de plata (AgCl)
Los iones plata (I) forman sales muy poco solubles con todos los halógenos. El caso del cloruro de plata es un ejemplo clásico de formación de precipitados en el laboratorio.
Carbonato de calcio (CaCO3)
El calcio es uno de los iones responsables de la dureza del agua. Cuando se calienta agua que contiene calcio, éste reacciona formando carbonato de calcio que precipita en forma de una capa blanca denominada sarro, que es capaz incluso de obstruir las tuberías.
Oxido hidratado de hierro (III) (Fe2O3.nH2O)
Este es otro ejemplo de un precipitado gelatinoso que se forma por la reacción de una solución que contiene iones hierro (III) con hidróxido de sodio o de potasio.
Hidróxido de magnesio (Mg(OH)2)
El magnesio es el otro catión responsable de la dureza del agua, ya que puede precipitar en forma de hidróxido de magnesio en tuberías y demás sistemas de calentamiento de agua.
Referencias
- Bancroft, W. D. (1918). Outline of colloid chemistry.—III. Journal of the Franklin Institute, 185(3), 373–387. https://doi.org/10.1016/s0016-0032(18)90710-6
- Civan, F. (2007). CRYSTAL GROWTH AND SCALE FORMATION IN POROUS MEDIA. Reservoir Formation Damage, 235–255. https://doi.org/10.1016/b978-075067738-7/50010-5
- Skoog, D. A., West, D. M., Holler, F. J., & Crouch, S. R. (2013). Fundamentals of Analytical Chemistry. New York City, New York: Cengage Learning.
- Wikipedia contributors. (2021, 10 enero). Precipitation (chemistry). Recuperado de en.wikipedia.org
