Micelas: concepto, estructura, función y formación
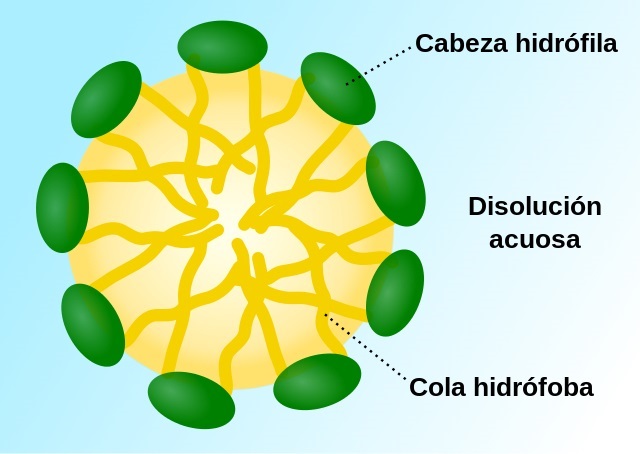
¿Qué son las micelas?
Las micelas son estructuras esféricas estables formadas por cientos de moléculas anfipáticas, es decir, moléculas que se caracterizan por tener una región polar (hidrofílica) y una apolar (hidrofóbica). Así como las moléculas que las componen, las micelas tienen un centro fuertemente hidrofóbico y su superficie está “tapizada” con grupos polares hidrofílicos.
Resultan, en la mayoría de los casos, de la mezcla de un grupo de moléculas anfipáticas con el agua, por lo que se trata de una forma de “estabilizar” las regiones hidrofóbicas de muchas moléculas en conjunto, hecho que es impulsado por el efecto hidrofóbico y organizado por fuerzas de van der Waals.
Tanto los detergentes y jabones, así como ciertos lípidos celulares, pueden formar micelas, las cuales tienen relevancia funcional, al menos en los animales, desde el punto de vista de la absorción de grasas y el transporte de sustancias liposolubles.
Los fosfolípidos, una de las clases de lípidos más abundante e importante para las células vivas, bajo ciertas condiciones pueden formar, además de liposomas y bicapas, unas estructuras micelares.
Las micelas también pueden formarse en un medio apolar y en ese caso se denominan “micelas reversas”, pues las regiones polares de las moléculas anfipáticas que las forman se “esconden” en el centro hidrofílico mientras las porciones apolares están en contacto directo con el medio que las contiene.
Estructura de las micelas
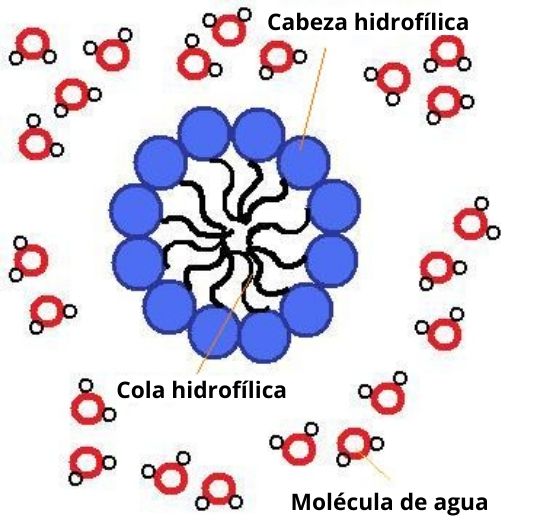
Las micelas están formadas por moléculas anfipáticas o, en otras palabras, por moléculas que tienen una región hidrofílica (afín al agua, polar) y otra región hidrofóbica (que repele al agua, apolar).
Entre estas moléculas pueden mencionarse los ácidos grasos, las moléculas de cualquier detergente y los fosfolípidos de las membranas celulares, por ejemplo.
En el contexto celular, una micela está comúnmente compuesta por ácidos grasos (de longitud variable), cuyos grupos carboxilos polares se exponen hacia la superficie del agregado, mientras que las cadenas hidrocarbonadas se “esconden” en un centro hidrofóbico, por lo que adoptan una estructura más o menos esférica.
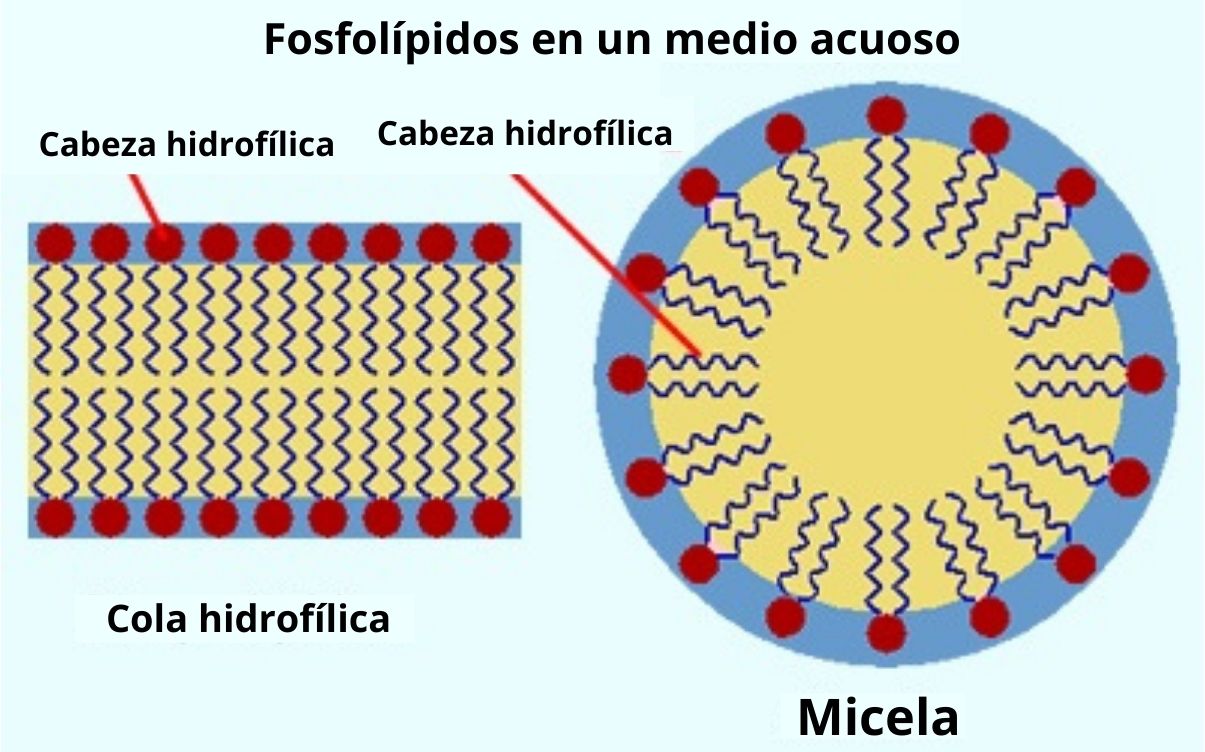
Los fosfolípidos, que son otras moléculas anfipáticas de gran importancia para las células, generalmente son incapaces de formar micelas, ya que las dos cadenas de ácidos grasos que conforman sus “colas hidrofóbicas” ocupan gran tamaño y hacen difícil la posibilidad de cualquier empaquetamiento de forma esférica.
En su lugar, cuando estas moléculas se encuentran en un medio acuoso, las mismas se “acomodan” en bicapas (de forma similar a un sándwich).
Se trata de estructuras más planas, donde cada una de las “superficies” expuesta hacia el medio está compuesta por las cabezas polares de los grupos unidos al glicerol y el “relleno” del sándwich consiste en las colas hidrofóbicas (los ácidos grasos esterificados a los otros dos carbonos del esqueleto de glicerol).
La única forma en la que es posible que un fosfolípido partícipe en la formación de una micela es cuando una de sus dos cadenas de ácidos grasos es removida por hidrólisis.
Organización
En una micela, como se ha comentado, el “centro” secuestra las porciones apolares de las moléculas que las componen y las aísla del agua.
La región central de una micela consiste, entonces, en un ambiente sumamente desordenado, con características tipo-fluido, en el cual la medida del radio es entre un 10 y un 30% menor que la de las cadenas completamente extendidas de las moléculas anfipáticas no asociadas con el complejo molecular.
Así mismo, la superficie de una micela no es homogénea sino más bien “rugosa” y heterogénea, de la cual algunos estudios de resonancia magnética nuclear indican que solo un tercio está cubierta por las porciones polares de los monómeros constituyentes.
Función
Las micelas tienen funciones muy significativas, tanto en la naturaleza como en la industria y en la investigación.
Respecto a sus funciones en la naturaleza, estos agregados moleculares son particularmente importantes para la absorción intestinal de grasas (monoglicéridos y ácidos grasos).
Micelas de distintos tamaños y composiciones pueden formarse a partir de las moléculas grasosas ingeridas con los alimentos y transportarlas hacia el interior de las células del revestimiento intestinal, haciendo posible su absorción.
Las micelas también funcionan en el transporte de colesterol (otra clase de lípido celular) adquirido con la dieta y de algunas vitaminas denominadas “liposolubles”, razón por la cual también son explotadas farmacológicamente para el transporte y la administración de drogas con características apolares.
Los detergentes y jabones empleados cotidianamente para el aseo personal o para la limpieza de distintos tipos de superficies están compuestos por moléculas lipídicas capaces de formar micelas cuando se encuentran en una solución acuosa.
Estas micelas se comportan como las bolas diminutas de un rodamiento, lo que les da a las soluciones jabonosas la consistencia resbalosa y las propiedades lubricantes. La acción de la mayor parte de los detergentes depende considerablemente de su capacidad para producir micelas.
En la investigación y el estudio de proteínas de membrana, por ejemplo, los detergentes son empleados para “depurar” los lisados celulares de los lípidos que forman las bicapas características de las membranas, así como para separar las proteínas integrales de membrana de los componentes hidrofóbicos de estas.
Formación
Para comprender la formación de las estructuras micelares, especialmente en los detergentes, es necesario tener en cuenta un concepto un tanto abstracto: la concentración micelar crítica o CMC.
La concentración micelar crítica es aquella concentración de moléculas anfipáticas a la cual comienzan a formarse las micelas. Se trata de un valor de referencia por encima del cual un aumento en la concentración de estas moléculas solo terminará con un aumento en el número de micelas, y por debajo del cual estas se organizan preferencialmente en capas sobre la superficie del medio acuoso que los contiene.
Así pues, la formación de micelas es una consecuencia directa de la “anfifilicidad” de los surfactantes y depende enormemente de las características estructurales de estos, sobre todo de la forma y de la relación de tamaño entre el grupo polar y el apolar.
En este sentido, la formación de micelas es favorecida cuando el área de sección transversal del grupo polar es mucho más grande que el del grupo apolar, como ocurre con los ácidos grasos libres, con los lisofosfolípidos y con detergentes como el dodecil sulfato de sodio (SDS).
Otros dos parámetros de qué depende la formación de micelas son:
- La temperatura: también se ha definido la temperatura micelar crítica (CMT, del inglés critical micellar temperature) que es aquella temperatura por encima de la cual se favorece la formación de micelas.
- La fuerza iónica: que es relevante, sobre todo, para los detergentes o surfactantes de tipo iónico (cuyo grupo polar posee una carga).
