Inflamasoma: activación y funciones
El inflamasoma es un complejo compuesto por varios dominios proteicos localizados en el citosol celular, cuya función es actuar como receptores y sensores del sistema inmune innato. Dicha plataforma es una barrera de defensa frente a la entrada de microorganismos patógenos, lo que dispara una respuesta inflamatoria mediada por la activación de la caspasa-1.
Varios estudios en ratones indican el papel del inflamasoma en la aparición de enfermedades graves para la salud pública. Por ello, se ha estudiado la elaboración de drogas que afecten el inflamasoma para mejorar enfermedades inflamatorias.
Los inflamasomas inducen enfermedades inflamatorias, autoinmunes y neurodegenerativas, tales como esclerosis múltiple, Alzheimer y Parkinson. Así como también, trastornos metabólicos como la ateroesclerosis, diabetes tipo 2 y obesidad.
Su descubrimiento fue efectuado por un conjunto de investigadores bajo la dirección del Dr. Tschopp (Martinon 2002). La formación de esta estructura se debe a la inducción de la respuesta inmune, cuya finalidad es la eliminación de microorganismos patógenos o funcionar como sensor y activador de procesos inflamatorios celulares.
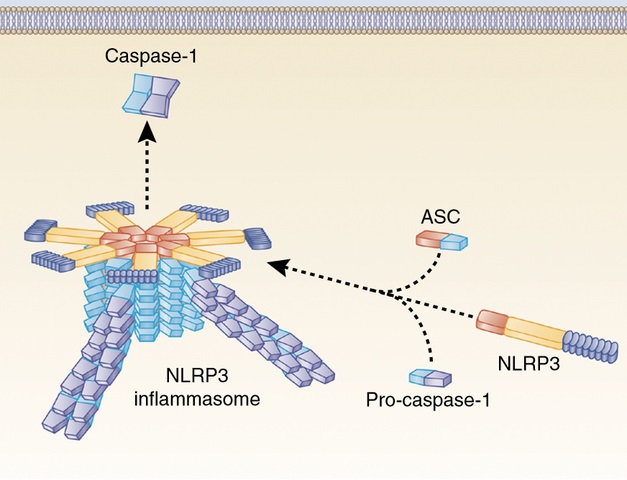
El ensamblaje de esta plataforma produce la estimulación de la procaspasa-1 o la procaspasa-11, que luego originan la formación de la caspasa-1 y la caspasa-11. Estos eventos originan la producción de citoquinas proinflamatorias del tipo interleucinas-1, llamadas interleucina-1 beta (IL-1β) e interleucina-18 (IL-18), que provienen de proIL-1β y proIL-18.
Los inflamasomas son importantes estructuras, activadas por una variedad de PAMPs (patrones moleculares asociados a un patógeno) y DAMPs (patrones moleculares asociados a un daño). Inducen el corte y liberación de las citocinas proinflamatorias interleucina-1 beta (IL-1β) and interleucina-18 (IL-18). Se forman por un receptor con dominio de unión a nucleótido (NLR) o AIM2, la ASC y la caspasa-1.
Índice del artículo
- 1 Activación del inflamasoma
- 2 Funciones del inflamasoma
- 3 Papel de los inflamasomas en el desarrollo de enfermedades
- 4 Referencias
Los inflamasomas son soldados que aparecen en el citosol celular. Este tipo de respuesta se debe a la presencia de agentes sospechosos como PAMPs y DAMPs (Lamkanfi y col, 2014). La activación de los receptores citoplasmáticos de la familia de dominio de unión a nucleótido (NLR) origina el complejo.
Algunos ejemplos son NLRP1, NLRP3 y NLRC4, así como también otros receptores como el llamado ausente en melanoma 2 (AIM2). Dentro de este grupo, el inflamasoma que se ha evaluado en mayor grado es el NLRP3, por su gran importancia fisiopatológica, en procesos infecciosos e inflamatorios. También participa la proteína adaptadora ASC y la proteína efectora caspasa-1.
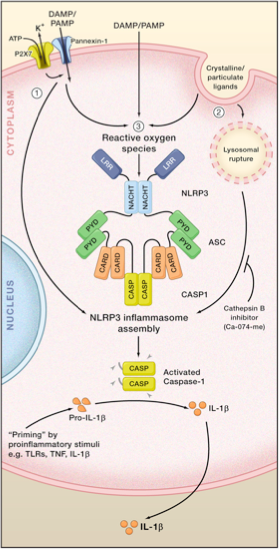
El inflamasoma de NLRP3 nace en respuesta a un grupo de señales que pueden ser componentes bacteriales, fúngicos, de protozoarios o virales. Así como también, otros factores como adenosina trifosfato (ATP), sílica, ácido úrico, ciertas toxinas inductoras de poros, entre otros muchos (Halle 2008). En la figura 1 se muestra la estructura de NLRP3.
El inflamasoma NLRP3 es activado por señales variadas, que se asemejan a fuego artificiales que indican a dicha estructura que empiece a funcionar. Ejemplos son la salida de potasio de la célula, la producción de componentes reactivos a oxígeno de la mitocondria (ROS), la liberación de cardiolipina, ADN mitocondrial o catepsina.
Las señales moleculares relacionadas a microorganismos patógenos (PAMP) o inductores de peligro (DAMP), y las citocinas proinflamatorias (como por ejemplo, TNF-α, IL-1β, IL-6, IL-18), despiertan NF-kB. Esta es la señal para la activación del inflamasoma NLRP3. Induce la producción de NLRP3, pro-IL1β y pro-IL-18, y de citocinas proinflamatorias como IL-6, IL-8 y TNF-α, entre otras.
Una señal posterior dice al inflamasoma NLRP3 que se ensamble para que luego aparezca el complejo NLRP3/ASC/Pro-caspasa-1, que informa a la caspasa-1 que debe activarse. El paso posterior induce que pro-IL-1β y pro-IL-18 maduren y se originan IL-1β e IL-18 en sus formas activas.
IL-1β e IL-18 son citocinas que apoyan el proceso inflamatorio. Asimismo, en conjunto con estos eventos, puede aparecer apoptosis y piroptosi.
El inflamosoma NLRP3 está en macrófagos, monocitos, células dendríticas y neutrófilos. Puede ser un ángel cuando ataca agentes infecciosos mediante la activación del proceso inflamatorio. O al contrario, un demonio que puede inducir el avance de varias enfermedades. Esto se origina por una activación desordenada y sin control cuando es afectada su regulación.
El inflamasoma es actor principal en eventos de la fisiología y patología de algunas enfermedades. Se ha observado que interviene en dolencias asociadas a inflamación. Por ejemplo, diabetes tipo 2 y ateroesclerosis (Duewell y col, 2010).
Algunos estudios muestran que los síndromes autoinflamatorios se deben a problemas en la regulación de NLPR3, lo cual origina una inflamación crónica muy profunda y desordenada, al parecer asociada a la producción de IL-1β. Con el uso de antagonistas de esta citocina, la enfermedad disminuye sus efectos nocivos sobre los individuos afectados (Meinzer y col, 2011).
Algunas investigaciones han mostrado que los inflamasomas son importantes en el daño producido durante enfermedades hepáticas. Imaeda y col. (2009) sugieren que el inflamasoma NLRP3 actúa en la hepatotoxicidad por acetaminofeno. Esos estudios observan que los ratones con tratamiento con acetaminofeno y falta de NLRP3, presentan una menor mortalidad.
El inflamasoma NLRP3 funciona como regulador de la homeostasis intestinal mediante la modulación de la respuesta inmune a la microbiota intestinal. En ratones deficientes en NLRP3 cambia la cantidad y tipo de microbiota (Dupaul-Chicoine y col, 2010).
En conclusión, el inflamasoma puede actuar del lado bueno como plataforma molecular que ataque infecciones, así como también, del lado oscuro como activador de Parkinson, Alzheimer, diabetes mellitus tipo 2 o ateroesclerosis, por mencionar solo algunas.
- Strowig, T., Henao-Mejia, J., Elinav, E. & Flavell, R. (2012). Inflammasomes in health and disease. Nature 481, 278-286.
- Martinon F, Burns K, Tschopp J. (2002). The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell, 10: 417-426.
- Guo H, Callaway JB, Ting JP. (2015). Inflammasomes: mechanism of action, role in disease, and therapeutics. Nat Med, 21(7):677-687.
- Lamkanfi, M. & Dixit, V.M. (2014). Mechanisms and functions of inflammasomes. Cell, 157, 1013-1022.
- Halle A, Hornung V, Petzold GC, Stewart CR, Monks BG, Reinheckel T, Fitzgerald KA, Latz E, Moore KJ & Golenbock DT. (2008). The NALP3 inflammasome is involved in the innate immune response to amyloid-beta. Nat. Immunol, 9:857-865.
- Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernfeind FG, et al. (2010). NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals. Nature, 464(7293):1357-1361.
- Meinzer U, Quartier P, Alexandra J-F, Hentgen V, Retornaz F, Koné-Paut I. (2011). Interleukin-1 targeting drugs in familial Mediterranean fever: a case series and a review of the literature. Semin Arthritis Rheum, 41(2):265-271.
- Dupaul-Chicoine J, Yeretssian G, Doiron K, Bergstrom KS, McIntire CR, LeBlanc PM, et al. (2010). Control of intestinal homeostasis, colitis, and colitis-associated colorectal cancer by the inflammatory caspases. Immunity, 32:367–78. doi: 10.1016/j.immuni.2010.02.012