Sulfato de amonio: qué es, estructura, propiedades, usos
¿Qué es el sulfato de amonio?
El sulfato de amonio es una sal inorgánica ternaria y amoniacal del ácido sulfúrico. Su fórmula química es (NH4)2SO4. Por lo tanto, las proporciones estequiométricas dicen que por cada anión sulfato hay dos cationes amonio interaccionando con él. Esto permite la neutralidad de la sal ((+1)∙2 + (-2)).
Su nomenclatura se debe al hecho de ser una sal derivada del H2SO4, cambiando el sufijo “úrico” por “ato”. Así, los dos protones iniciales son sustituidos por NH4+, producto de la reacción con amoníaco (NH3). Entonces, la ecuación química para su síntesis es: 2 NH3 + H2SO4 => (NH4)2SO4
También se prepara el sulfato de amonio mediante la reacción del carbonato de amonio con sulfato de calcio: (NH4)2CO3 + CaSO4 => (NH4)2SO4 + CaCO3, precipitando el carbonato de calico, el cual es se separa del líquido remanente.
El sulfato de amonio es almacenador de nitrógeno y azufre, ambos indispensables en la química de los suelos y los fertilizantes.
Estructura química del sulfato de amonio
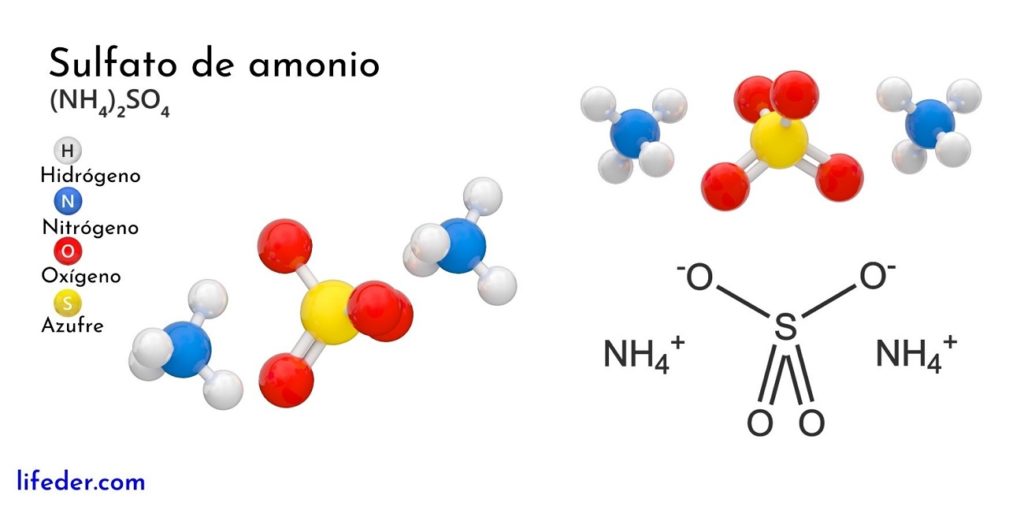
La imagen superior ilustra las geometrías moleculares de los iones NH4+ y SO42-. Las esferas rojas corresponden a los átomos de oxígeno, las blancas a los átomos de hidrógeno, la azul al átomo de nitrógeno y la amarilla al átomo de azufre.
Ambos iones pueden ser considerados como dos tetraedros, teniendo así tres unidades que interaccionan para formar un arreglo cristalino ortorrómbico. El anión sulfato es SO42- y es capaz donar o aceptar cuatro puentes de hidrógeno, al igual que el catión NH4+.
Propiedades del sulfato de amonio
Peso molecular
132,134 g/mol.
Aspecto físico
Sólido blanco. Cristales ortorrómbicos blancos o marrones, dependiendo de los niveles de impureza.
Olor
Inodoro.
Punto de fusión
280 ºC. Este punto de fusión, bajo frente a otros compuestos iónicos, se debe a que es una sal con cationes monovalentes (+1) y con iones disimilares en sus tamaños, ocasionando que el sólido tenga una baja energía reticular cristalina.
Solubilidad
76,4 g/100 g de agua a 25 ºC. Esta afinidad por el agua se debe a la gran capacidad que tienen sus moléculas para solvatar los iones amonio. Por otro lado, es insoluble en acetona y en alcohol; es decir, en solventes menos polares que el agua.
Densidad
1,77 g/cm3 a 25 ºC.
Presión de vapor
1,871 kPa a 20 ºC.
Punto de inflamabilidad
26 ºC.
pH
5,0 – 6,0 (25 ºC. solución 1 M). El pH ligeramente ácido es debido a la hidrólisis del NH4+ en agua, produciendo H3O+ a bajas concentraciones.
Estabilidad
Estable en condiciones ambientales adecuadas. En contacto con oxidantes fuertes puede incendiarse.
Descomposición
Comienza a descomponerse a 150 ºC, liberando vapores tóxicos de óxido de azufre, óxido de nitrógeno y amonio.
Corrosión
No ataca al hierro ni al aluminio.
Usos del sulfato de amonio
En la agricultura
- El sulfato de amonio es usado como fertilizante en los suelos alcalinos. La sal de amonio tiene en su composición un 21 % de nitrógeno y un 24 % de azufre. Sin embargo, hay compuestos que aportan una cantidad de nitrógeno mayor que el sulfato de amonio; la ventaja de este último es su alta concentración de azufre.
- El azufre es imprescindible en la síntesis de proteínas, ya que varios aminoácidos —como la cistina, la metionina y la cisteína— poseen azufre. Por estas razones, el sulfato de amonio continúa siendo uno de los fertilizantes más importantes.
- Se usa en los cultivos de trigo, maíz, arroz, algodón, papa, cáñamo y árboles frutales.
- Baja el pH de los suelos alcalinos por su aporte en el proceso de nitrificación realizado por los microbios. Se usa el amonio (NH4+) para producir nitrato (NO3–) y liberar H+: 2NH4+ + 4O2 => 2NO3– + 2H2O + 4H+. El aumento de la concentración de hidrógeno disminuye el pH de los suelos alcalinos y permite más aprovechamiento.
- Además de su uso como fertilizante, el sulfato de amonio actúa como coadyuvante de los insecticidas solubles, los herbicidas y los fungicidas, los cuales son rociados sobre los cultivos.
- El sulfato es capaz de secuestrar iones presentes en el suelo y en el agua de riego que son necesarios para la vida de ciertos agentes patógenos. Entre los iones que capta el sulfato de amonio están el Ca2+, el Mg2+, el Fe2+ y el Fe3+. Esta acción potencia el efecto microbicida de los agentes mencionados.
Como reactivo analítico
El sulfato de amonio actúa como agente precipitante en análisis electroquímico, en medio de cultivo microbiológicos y en la preparación de sales de amonio.
En la precipitación y aislamiento de proteínas
El sulfato de amonio se utiliza en el aislamiento y la purificación de proteínas, especialmente de las plasmáticas. Al plasma se le añade una cantidad de sulfato de amonio hasta llevarlo a una concentración determinada; así, se provoca la precipitación de un grupo de proteínas.
Se recoge el precipitado por centrifugación y al sobrenadante se le agrega una cantidad adicional de sulfato de amonio y, a una nueva concentración, se produce la precipitación de otro grupo de proteínas.
La repetición del proceso anterior en forma secuencial permite como resultado la obtención de diferentes fracciones de proteínas plasmáticas.
Antes de aparecer las nuevas tecnologías de la biología molecular, este procedimiento permitió el aislamiento de proteínas plasmáticas de gran importancia en la medicina, por ejemplo: inmunoglobulinas, factores de la coagulación, etc.
En la industria
El sulfato de amonio actúa retardando el inicio del fuego en la industria textil. Se usa como aditivo en la industria de electroenchapado. Asimismo, es utilizado en la producción de peróxido de hidrógeno, cloruro de amonio, etc.
Otros usos
- El sulfato de amonio es utilizado como un agente regulador de la presión osmótica y como agente precipitante de sales.
- Bajo la forma de lauril sulfato de amonio, disminuye la tensión superficial del agua, permitiendo de este modo la separación de contaminantes mediante un incremento de la dureza del agua.
- Es un agente anticorrosivo.
- Se usa como aditivo de alimentos que regula la acidez en la masa de harina y en el pan.
