¿Qué es la Notación Espectral?
La notación espectral es la disposición de electrones en niveles de energía alrededor del núcleo de un átomo. Según el antiguo modelo atómico de Bohr, los electrones ocupan varios niveles en órbitas alrededor del núcleo, de la primera capa más cercana al núcleo, K, hasta la séptima capa, Q, que es la más alejada del núcleo.
En términos de un modelo mecánico cuántico más refinado, las capas K-Q se subdividen en un conjunto de orbitales, cada uno de los cuales puede ser ocupado por no más de un par de electrones.

Comúnmente, la configuración electrónica se utiliza para describir los orbitales de un átomo en su estado fundamental, pero también puede usarse para representar un átomo que se ha ionizado en un catión o anión, compensando con la pérdida o ganancia de electrones en sus respectivos orbitales.
Muchas de las propiedades físicas y químicas de los elementos pueden correlacionarse con sus configuraciones electrónicas únicas. Los electrones de valencia, los electrones en la capa más externa, son el factor determinante para la química única del elemento.
Cuando los electrones de la capa más externa de un átomo reciben energía de algún tipo, estos se trasladan a capas de mayor energía. Así, un electrón en la capa K será trasladado a la capa L estando en un estado de mayor energía.
Cuando el electrón regresa a su estado fundamental, libera la energía que absorbió emitiendo un espectro electromagnético (luz). Dado que cada átomo tiene una configuración electrónica específica, también tendrá un espectro específico que se llamará espectro de absorción (o de emisión).
Por esta razón, se usa el término notación espectral para referirse a la configuración electrónica.
Cómo determinar la notación espectral: números cuánticos
Un total de cuatro números cuánticos se utilizan para describir completamente el movimiento y las trayectorias de cada electrón dentro de un átomo.
La combinación de todos los números cuánticos de todos los electrones en un átomo se describe por una función de onda que cumple con la ecuación de Schrödinger. Cada electrón en un átomo tiene un conjunto único de números cuánticos.
De acuerdo con el Principio de Exclusión de Pauli, dos electrones no pueden compartir la misma combinación de cuatro números cuánticos.
Los números cuánticos son importantes porque pueden usarse para determinar la configuración electrónica de un átomo y la probable ubicación de los electrones del átomo.
Los números cuánticos también se utilizan para determinar otras características de los átomos, como la energía de ionización y el radio atómico.
Los números cuánticos designan conchas específicas, subcapas, orbitales y giros de electrones.
Esto significa que describen completamente las características de un electrón en un átomo, es decir, describen cada solución única a la ecuación de Schrödinger, o la función de onda, de electrones en un átomo.
Hay un total de cuatro números cuánticos: el número cuántico principal (n), el número cuántico del momento angular orbital (l), el número cuántico magnético (ml) y el número cuántico del spin del electrón (ms).
El número cuántico principal, nn, describe la energía de un electrón y la distancia más probable del electrón del núcleo. En otras palabras, se refiere al tamaño del orbital y al nivel de energía en que se coloca un electrón.
El número de subcapas, o ll, describe la forma del orbital. También puede usarse para determinar el número de nodos angulares.
El número cuántico magnético, ml, describe los niveles de energía en una subcapa, y ms se refiere al spin sobre el electrón, que puede ser hacia arriba o hacia abajo.
Principio de Aufbau
Aufbau proviene de la palabra alemana “Aufbauen” que significa “construir”. En esencia, al escribir configuraciones de electrones estamos construyendo orbitales de electrones a medida que avanzamos de un átomo a otro.
A medida que escribimos la configuración electrónica de un átomo, llenaremos los orbitales en orden creciente de número atómico.
El principio de Aufbau se origina en el principio de exclusión de Pauli que dice que no hay dos fermiones (por ejemplo, electrones) en un átomo.
Pueden tener el mismo conjunto de números cuánticos, por lo que tienen que “acumularse” en niveles de energía más altos. Cómo los electrones se acumulan es un tema de configuraciones de electrones.
Los átomos estables tienen tantos electrones como hacen los protones en el núcleo. Los electrones se reúnen alrededor del núcleo en orbitales cuánticos siguiendo cuatro reglas básicas llamadas principio Aufbau.
- No hay dos electrones en el átomo que comparten los mismos cuatro números cuánticos n, l, m, y s.
- Los electrones ocuparán primero los orbitales del nivel de energía más bajo.
- Los electrones irán llenando los orbitales siempre con el mismo número de spin. Cuando los orbitales estén llenos comenzará.
- Los electrones llenarán orbitales por la suma de los números cuánticos n y l. Los orbitales con valores iguales de (n + l) se llenarán primero con los valores de n inferiores.
La segunda y cuarta reglas son básicamente las mismas. Un ejemplo de la regla cuatro sería los orbitales 2p y 3s.
Un orbital 2p es n = 2 y l = 2 y un orbital 3s es n = 3 y l = 1. (N + l) = 4 en ambos casos, pero el orbital 2p tiene la menor energía o menor valor n y se llenará antes de la capa 3s.
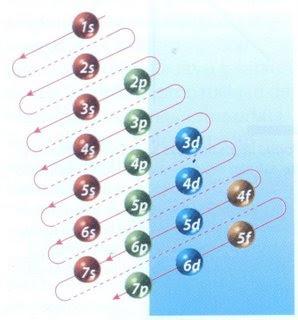
Afortunadamente, se puede usar el diagrama de Moeller mostrado en la figura 2 para hacer el llenado de electrones. El gráfico se lee ejecutando las diagonales desde 1s.
La figura 2 muestra los orbitales atómicos y las flechas siguen el camino a seguir.
Ahora que se sabe que el orden de los orbitales se llena, lo único que queda es memorizar el tamaño de cada orbital.
S orbitales tienen 1 valor posible de ml para contener 2 electrones
P orbitales tienen 3 valores posibles de ml para contener 6 electrones
D orbitales tienen 5 valores posibles de ml para contener 10 electrones
F orbitales tienen 7 valores posibles de ml para contener 14 electrones
Esto es todo lo que se necesita para determinar la configuración electrónica de un átomo estable de un elemento.
Por ejemplo, tome el elemento nitrógeno. El nitrógeno tiene siete protones y por lo tanto siete electrones. El primer orbital a llenar es el orbital 1s. Un orbital s tiene dos electrones, por lo que quedan cinco electrones.
El orbital siguiente es el orbital 2s y contiene los dos siguientes. Los tres electrones finales irán al orbital 2p que puede contener hasta seis electrones.
Reglas de Hund
La sección de Aufbau discutió cómo los electrones llenan los orbitales de la energía más baja primero y después se mueven hasta los orbitales de la energía más alta solamente después de que los orbitales de la energía más baja estén llenos.
Sin embargo, hay un problema con esta regla. Ciertamente, los orbitales 1s deben llenarse antes de los orbitales 2s, porque los orbitales 1s tienen un valor menor de n, y por lo tanto una energía más baja.
¿Y los tres orbitales 2p diferentes? ¿En qué orden deben ser llenados? La respuesta a esta pregunta involucra la regla de Hund.
La regla de Hund establece que:
– Cada orbital en un subnivel es ocupado individualmente antes de que cualquier orbital esté doblemente ocupado.
– Todos los electrones en orbitales ocupados individualmente tienen el mismo giro (para maximizar el giro total).
Cuando se asignan electrones a orbitales, un electrón primero busca llenar todos los orbitales con energía similar (también denominados orbitales degenerados) antes de emparejarse con otro electrón en un orbital medio lleno.
Los átomos en los estados de tierra tienden a tener tantos electrones desemparejados como sea posible. Al visualizar este proceso, considere cómo los electrones exhiben el mismo comportamiento que los mismos polos en un imán si entraran en contacto.
Cuando los electrones cargados negativamente llenan los orbitales, primero tratan de alejarse lo más posible el uno del otro antes de tener que emparejarse.
Referencias
- Anastasiya Kamenko, T. E. (2017, Marzo 24). Quantum Numbers. Recuperado de chem.libretexts.org.
- Aufbau Principle. (2015, Junio 3). Recuperado de chem.libretexts.org.
- Electron Configurations and the Properties of Atoms. (S.F.). Recuperado de oneonta.edu.
- Encyclopædia Britannica. (2011, Septiembre 7). Electronic configuration. Recuperado de britannica.com.
- Helmenstine, T. (2017, Marzo 7). The Aufbau Principle – Electronic Structure and the Aufbau Principle. Recuperado de thoughtco.com.
- Hund’s Rules. (2015, Julio 18). Recuperado de chem.libretexts.org.
- Spectroscopic Notation. (S.F.). Recuperado de bcs.whfreeman.com.
