Carbonato de aluminio: estructura, propiedades, usos
El carbonato de aluminio es una sal inorgánica cuya fórmula química es Al2(CO3)3. Es un carbonato metálico prácticamente inexistente, dada su alta inestabilidad en condiciones normales.
Entre las razones de su inestabilidad se puede mencionar las débiles interacciones electrostáticas entre los iones Al3+ y CO32-, las cuales en teoría deberían ser muy fuertes por las magnitudes de sus cargas.
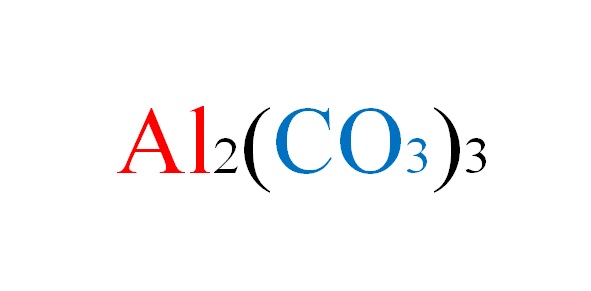
La sal no enfrenta ningún inconveniente en el papel cuando se escriben las ecuaciones químicas de sus reacciones; pero en la práctica se pone en su contra.
A pesar de lo dicho, el carbonato de aluminio sí puede presentarse en compañía de otros iones, como ocurre con el mineral dawsonita. Asimismo, existe un derivado en el que interactúa con el amoníaco acuoso. De resto, se considera una mezcla entre Al(OH)3 y H2CO3; lo que es igual a una solución efervescente con un precipitado blanco.
Dicha mezcla tiene usos medicinales. Sin embargo, a la sal pura, aislable y manipulable de Al2(CO3)3, no se le conoce aplicaciones posibles; al menos no bajo enormes presiones o condiciones extremas.
Índice del artículo
La estructura cristalina para esta sal es desconocida, debido a que es tan inestable que no ha podido caracterizarse. A partir de su fórmula Al2(CO3)3, sin embargo, se sabe que la proporción de los iones Al3+ y CO32- es 2:3; es decir que por cada dos cationes Al2+ tienen que haber tres aniones CO32- interaccionando electrostáticamente con ellos.
El problema es que ambos iones son muy desiguales respecto a sus tamaños; el Al3+ es muy pequeño mientras que el CO32- es voluminoso. Esta diferencia por sí misma ya afecta la estabilidad reticular de la red cristalina, cuyos iones interaccionarían “torpemente” de poder aislarse esta sal en estado sólido.
Además de este aspecto, el Al3+ es un catión altamente polarizante, propiedad que deforma la nube electrónica del CO32-. Es como si quisiera forzarlo a enlazarse covalentemente, aun cuando el anión no puede hacerlo.
En consecuencia, las interacciones iónicas entre el Al3+ y CO32- tienden hacia la covalencia; otro factor que suma a la inestabilidad del Al2(CO3)3.
La relación caótica entre el Al3+ y CO32- se suaviza en apariencia cuando hay otros iones presentes en el cristal; tales como el NH4+ y OH–, provenientes de una disolución de amoníaco. Este cuarteto de iones, Al3+, CO32-, NH4+ y OH–, sí logran definir cristales estables, incluso capaces de adoptar distintas morfologías.
Otro ejemplo parecido a este se observa en el mineral dawsonita y sus cristales ortorrómbicos, NaAlCO3(OH)2, donde el Na+ sustituye al NH4+. En estas sales sus enlaces iónicos son lo suficiente fuertes para que el agua no promueva la liberación de CO2; o al menos, no de manera abrupta.
Aunque el NH4Al(OH)2CO3 (AACC, por sus sigles en inglés), ni el NaAlCO3(OH)2 representan al carbonato de aluminio, pueden considerarse como derivados básicos del mismo.
233,98 g/mol.
En el apartado anterior se explicó desde una perspectiva molecular por qué el Al2(CO3)3 es inestable. Pero, ¿qué transformación sufre? Hay que considerar dos situaciones: una seca, y la otra “mojada”.
Seca
En la situación seca, el anión CO32- se revierte a CO2 mediante la siguiente descomposición:
Al2(CO3)3 => Al2O3 + 3CO2
Lo cual tiene sentido si esta se sintetiza sometido a la alúmina a grandes presiones de CO2; esto es, la reacción inversa:
Al2O3 + 3CO2 => Al2(CO3)3
Por lo tanto, para evitar que se descomponga el Al2(CO3)3 habría que someter la sal a grandes presiones (utilizando N2, por ejemplo). De esta manera la formación del CO2 no estaría termodinámicamente favorecida.
Mojada
Mientras que en la situación mojada, el CO32- sufre hidrólisis, lo cual genera pequeñas cantidades de OH–; pero suficientes para que precipite el hidróxido de aluminio, Al(OH)3:
CO32- + H2O => HCO3– + OH–
Al3+ + 3OH– => Al(OH)3
Y por otro lado, el Al3+ también se hidroliza:
Al3+ + H2O => Al(OH)22+ + H+
Aunque realmente primero se hidrataría el Al3+ para formar el complejo Al(H2O)63+, el cual se hidroliza para dar [Al(H2O)5OH]2+ y H3O+. Luego, el H3O (o H+) protona al CO32- a H2CO3, el cual se descompone a CO2 y H2O:
CO32- + 2H+ => H2CO3
H2CO3 => CO2 + H2O
Nótese que al final el Al3+ se comporta como un ácido (libera H+) y una base (libera OH– con el equilibrio de solubilidad del Al(OH)3); es decir, exhibe anfoterismo.
De poder aislarse, es probable que esta sal sea de color blanco, como muchas otras sales de aluminio. Asimismo, debido a la diferencia entre los radios iónicos del Al3+ y CO32-, seguramente tendría puntos de fusión o ebullición muy bajos en comparación a otros compuestos iónicos.
Y respecto a su solubilidad, sería infinitamente soluble en agua. Además, sería un sólido higroscópico y delicuescente. Sin embargo, estas son solo conjeturas. Otras propiedades tendrían que estimarse con modelos computaciones sometidos a altas presiones.
Las aplicaciones que se conocen del carbonato de aluminio son médicas. Fue usado como un astringente suave y como droga para tratar la inflamación y úlcera gástrica. También ha sido usado para prevenir la formación de cálculos urinarios en humanos.
Se ha empleado para controlar un aumento en el contenido corporal de fosfato y también para tratar los síntomas de acidez estomacal, indigestión ácida y las úlceras estomacales.
- XueHui L., Zhe T., YongMing C., RuiYu Z. & Chenguang L. (2012). Hydrothermal Synthesis of Ammonium Aluminum Carbonate Hydroxide (AACH) Nanoplatelets and Nanofibers pH-Controlled Morphologies. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammonium aluminium carbonate hydroxide NH4Al(OH)2CO3 as an alternative route for alumina preparation: comparison with the classical boehmite precursor. Powder Technology, 320, 565-573, DOI: 10.1016/j.powtec.2017.07.0080
- National Center for Biotechnology Information. (2019). Aluminum carbonate. PubChem Database., CID=10353966. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Aluminium carbonate. Recuperado de: en.wikipedia.org
- Aluminumsulfate. (2019). Aluminum Carbonate. Recuperado de: aluminumsulfate.net
