Ácido débil: definición, características, cálculo, ejemplos
¿Qué es un ácido débil?
Un ácido débil es aquel que en disolución acuosa tiene poca capacidad de disociarse en hidrógeno (H+) y en su correspondiente base conjugada. A diferencia de los ácidos fuertes, cuya disociación es completa (100%) y prácticamente irreversible, los ácidos débiles apenas se disocian y de un modo reversible.
Por lo tanto, un ácido débil genera menos iones H+ en agua de lo que se esperaría. Entre los ácidos débiles más representativos tenemos el ácido acético, principal componente del vinagre, el cual se ioniza aproximadamente en un 0.5 % bajo condiciones normales.
Esto significa que la mayor proporción de una solución de ácido acético en agua, como la del vinagre de cocina al 5%, se encuentra en forma no disociada (CH3COOH); mientras que una pequeña porción se encuentra como la base conjugada (CH3COO–), acompañada de iones H+, o más correctamente, iones H3O+.
Entonces, al ser baja la cantidad de hidrógeno que es liberada por un ácido débil en solución acuosa, el pH que producen es más alto (básico) que el producido por un ácido fuerte. Por ejemplo, el vinagre tiene un pH de 2.5, el jugo de naranja pH 3.3 – 4.2 y el jugo de limón pH de 2.
Estos pH, si bien son ácidos, son más altos que los pH que producen una solución de un ácido fuerte (HCl, H2SO4, etc.) que pueden alcanzar el valor de 1 o menos (valores de pH negativos).
Características de los ácidos débiles
pH de sus disoluciones
Los ácidos débiles, usualmente, tienen un pH comprendido entre 2.0 y menos de 7.0, por lo que tornan en rojo el color del papel tornasol. Estos valores de pH son muchos más altos que los valores de pH producidos por los ácidos fuertes, aunque hay excepciones.
Por ejemplo, una solución 1 mM de ácido clorhídrico (un ácido fuerte), tiene un pH de 3.0, mientras una solución 1 mM de ácido fluorhídrico (un ácido “débil”), tiene un pH de 3.2, el cual es cercano al del ácido fuerte.
Ionización parcial
Los ácidos débiles en solución se ionizan poco o parcialmente en el agua, disociándose en la base conjugada del ácido y el ión hidrógeno. Entonces, un ácido débil en solución acuosa se encuentra en su mayor parte no disociado, con una pequeña proporción disociado.
Al ser baja la cantidad de hidrógeno liberada por un ácido débil en agua, el pH producido por este ácido es más alto que el producido por un ácido fuerte disuelto en agua, ya que estos se suelen ionizar en un 100 %.
Ionización reversible
La ionización de un ácido débil se suele esquematizar en la forma siguiente:
HA ⇌ A– + H3O–
Donde HA es el ácido débil, A– su base conjugada, y H3O+ el catión hidronio, que es la forma como el H+ existe o se manifiesta en el agua. La concentración (o actividad) del H3O+ se utiliza en lugar del H+ para la determinación del pH de la solución.
Grado de ionización
Algunos ácidos son más débiles que otros, lo que es igual a decir, que están menos ionizados. Por lo tanto, el grado de ionización permite entrever qué tan ácida es la disolución de un ácido bajo determinadas condiciones.
Para expresar el grado de ionización se introdujo varios parámetros, como la constante de ionización o acidez (Ka) y el pKa: una forma de expresar Ka en un número simple que omite el uso de un número expresado en potencias negativas de diez (10), tal como existe en el Ka.
Las constantes Ka y pKa son usadas fundamentalmente para los ácidos débiles.
Ka = [A–][H+] / [HA]
Los corchetes presentes en la fórmula representan concentraciones.
pKa = – log Ka
El valor del pKa de un ácido débil oscila usualmente entre 2 y 12. Pero hay excepciones. Por ejemplo: el ácido yódico (HIO3) tiene un pKa de 0.77, lo que se considera un valor relativamente pequeño, pero sin ser negativo, para un ácido débil en un sentido estricto.
Estabilidad de la base conjugada
Los ácidos débiles tienen un enlace fuerte con el átomo de hidrógeno ácido (Hδ+-Xδ-), por lo que tienen un bajo grado de disociación del hidrógeno. Esto trae como consecuencia que la base conjugada del ácido débil tenga una gran avidez por el hidrógeno, siendo una base conjugada fuerte.
Es decir, que la base conjugada de un ácido débil es muy inestable, porque acepta el H+ devuelta con mucha facilidad. Mientras más inestable sea dicha base conjugada, más débil será el ácido en cuestión.
Baja conductividad iónica
Al ser poco ionizados, los ácidos débiles son pobres conductores de la electricidad, al contrario de los ácidos fuertes que sí son buenos conductores de la electricidad.
Presencia en la naturaleza
Los ácidos débiles se encuentran ampliamente distribuidos en la naturaleza, por ejemplo, están en las frutas cítricas (limón, pomelo, naranja, etc).
También se encuentran presentes en numerosos procesos que ocurren en todos los seres vivos. Algunos de estos ácidos débiles biológicos son el pirúvico, láctico, cítrico, fumárico, succínico, glutámico, etc., e inclusive la hemoglobina oxigenada libera hidrogeniones, por lo que se comporta como un ácido débil.
Entonces, puede concluirse que el hombre vive en contacto permanente con los ácidos débiles.
¿Cómo calcular el pH de un ácido débil?
El pH de un ácido débil puede calcularse mediante el uso de la constante de ionización del ácido (Ka), o utilizando la ecuación de Henderson-Hasselbalch. En el primer ejemplo se usará Ka.
Con la constante de acidez
Calcular el pH de una solución 0.5 M de ácido benzoico (C6H5COOH), el cual tiene una constante de ionización (Ka) = 1.8 x 10-5
C6H5COOH ⇌ C6H5COO– + H+ (1)
Si se llama X a la cantidad de ácido que se disocia, entonces 0.5 M-X será la concentración del ácido débil no disociado en el equilibrio, siendo X la concentración de la base conjugada del ácido benzoico y la concentración del ion hidrogeno.
La ecuación (1) puede representarse en la forma siguiente:
0.5 M-X ⇌ X + X
Los ácidos débiles se ionizan en una proporción muy baja, por lo que la concentración del ácido benzoico en el equilibrio de (0.5 M-X), puede asumirse como 0.5 M, ya que X < 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [A–] [H+] / [HA]
1.8 x 10-5 = (X)(X) / 0.5 M
X2 = (1.8 x 10-5)(0.5 M)
X = 3 x 10-3 M
Por lo tanto, [H+] es igual a 3 x 10-3 M. Resolvemos entonces calculando el pH:
pH = – log [H+]
= – log [3 x 10-3]
pH = 2.52
Nótese que el pH es relativamente ácido, pues se ubica por debajo de 3 o 4.
Con ecuación de Henderson-Hasselbalch
La ecuación de Henderson-Hasselbalch es utilizada para calcular el pH de una solución amortiguadora:
pH = pKa + log [base conjugada] / [ácido]
Ejemplo:
Se añade hidróxido de sodio (NaOH) a una solución de ácido acético, produciendo una concentración final de ácido acético (CH3COOH) de 1.11 x 10-2 mol/L y una concentración de la base conjugada (CH3COO–) de 0.44 x 10-2 mol/L. Si el pKa del ácido acético es 4.75 calcule el pH de la solución.
pH = 4.75 + log [A–] / [HA]
pH = 4.75 + log (0.44 x 10-2 / 1.11 x 10-2)
= 4.75 + log 0.396
= 4.348
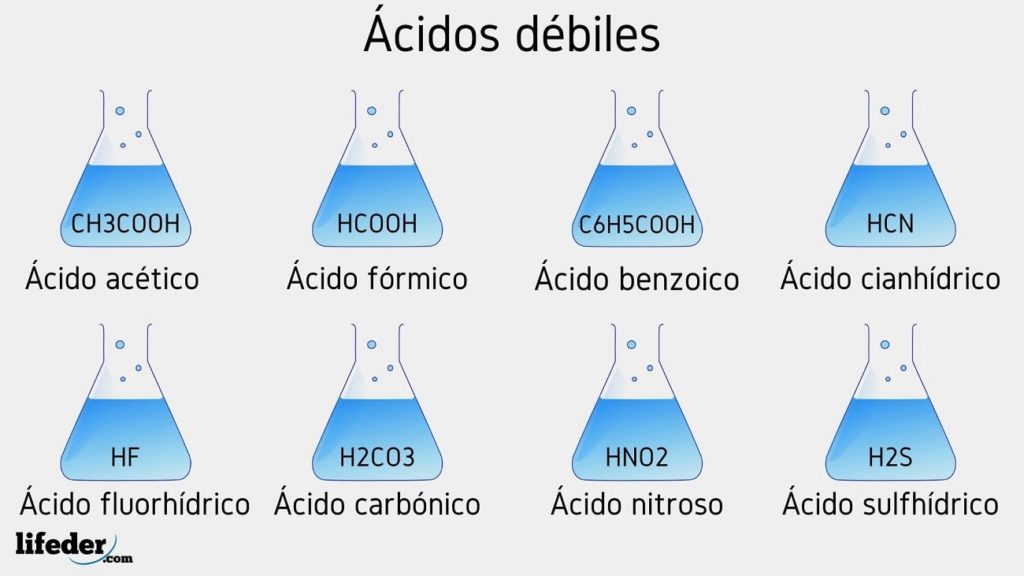
Ejemplos de ácidos débiles
A continuación se enlistarán varios ácidos débiles acompañados de sus valores de pKa:
- CH3COOH (ácido acético), pKa 4.75
- HCOOH (ácido fórmico), pKa 3.74
- C6H5COOH (ácido benzoico), pKa 5.59
- CH2ClCOOH (ácido cloroacético), pKa 2.85
- HCN (ácido cianhídrico), pKa 9.31
- HF (ácido fluorhídrico), pKa 3.17
- C2H5COOH (ácido propiónico), pKa 4.89
- HNO2 (ácido nitroso), pKa 3.35
- H2S (ácido sulfhídrico), pKa1 6.0 y pKa2 12.92
- CCl3COOH (ácido tricloroacético), pKa 0.52
- H2CO3 (ácido carbónico), pKa1 6.37 y pKa2 10.22
- H3PO4 (ácido fosfórico), pKa1 2.12, pKa2 4.21 y pKa3 11.0
- C6H5SO3H (ácido bencenosulfónico), pKa 0.70
- HIO3 (ácido yódico), pKa 0.77
- HClO2 (ácido cloroso), pKa 2.0
- CH3CH2(OH)COOH (ácido láctico), pKa 3.08
Ácidos débiles con usos terapéuticos
- Ácido salicílico, pKa 3.00
- Ácido acetilsalicílico, pKa 3.49
- Furosemida, pKa 3.90
- Ibuprofen, pKa 4.40
- Levodopa, pKa 2.30
- Fenobarbital, pKa 7.40
- Warfarina, pKa 5.0
- Teofilina, pKa 8.80
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Morris, J. G. (1974). Fisicoquímica Para Biólogos. (2da ed.). Reverté.
- Helmenstine, Anne Marie, Ph.D. (29 de agosto de 2020). Weak Acid Definition and Examples in Chemistry. Recuperado de: thoughtco.com
- Ophardt C., & McCarthy L. (15 de agosto de 2020). Acid and Base Strength. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Clark Jim. (2013). Strong and weak acids. Recuperado de: chemguide.co.uk
- Lumen Learning. (s.f.). Chemistry for Non-Majors: Calculating pH of Weak Acid and Base Solutions. Recuperado de: courses.lumenlearning.com
