Fosfato de aluminio (AlPO4): estructura, propiedades, obtención, usos
El fosfato de aluminio es un sólido inorgánico formado por un ion aluminio Al3+ y un ion fosfato PO43-. Su fórmula química es AlPO4. Se trata de un sólido blanco cuya estructura cristalina es semejante a la de la sílice SiO2. Es insoluble en agua.
Se puede obtener a partir de alúmina (Al2O3) y ácido fosfórico (H3PO4). También se puede obtener partiendo de soluciones acuosas de cloruro de aluminio (AlCl3) y fosfato de sodio (Na3PO4).

El fosfato de aluminio tiene un punto de fusión muy alto, por lo que es muy utilizado como componente de cerámicas refractarias, es decir, cerámicas que aguantan temperaturas muy altas.
Se emplea además como antiácido para el estómago, en mezclas para la reparación de los dientes y como adyuvante de vacunas, esto es, para estimular la respuesta inmune del organismo.
Algunos concretos refractarios poseen AlPO4 en su composición, el cual incrementa las propiedades mecánicas y de soporte de altas temperaturas de este tipo de cementos.
Ha sido utilizado como escudo protector para evitar que se quemen materiales combustibles como ciertos polímeros.
Índice del artículo
El AlPO4 está formado por un catión aluminio Al3+ y un anión fosfato PO43-.
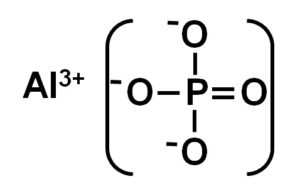
El fosfato de aluminio cristalino se denomina también berlinita o fase alfa (α-AlPO4) y sus cristales son similares al cuarzo.

La fase alfa del fosfato de aluminio es un sólido formado por una red covalente de tetraedros de PO4 y AlPO4 que se alternan y están unidos por los átomos de oxígeno.
Esta estructura es isomorfa con la sílice, es decir, tiene la misma forma que la de la sílice SiO2.
– Fosfato de aluminio
– Monofosfato de aluminio
– Sal de aluminio del ácido fosfórico.
Sólido blanco cristalino.
121,93 g/mol
1800 ºC
2,56 g/cm3
Insoluble en agua
La estructura del AlPO4 es muy similar a la de la sílice SiO2, por lo que comparte muchas propiedades físicas y químicas de esta.
El fosfato de aluminio es un material altamente refractario, es decir, resiste temperaturas muy altas sin cambiar su estado físico ni su estructura y sin descomponerse.
El AlPO4 cristalino o berlinita cuando se calienta se convierte a una estructura tipo tridimita y luego tipo cristobalita, otras formas de este compuesto que lo asemejan a la sílice SiO2.

El fosfato de aluminio AlPO4 se puede obtener mediante la reacción entre el ácido fosfórico H3PO4 y alúmina Al2O3. Se requiere aplicación de temperatura, por ejemplo entre 100 y 150 °C.
Al2O3 + 2 H3PO4 = 2 AlPO4 + 3 H2O
También se puede obtener uniendo una solución acuosa de cloruro de aluminio AlCl3 con una solución acuosa de fosfato de sodio Na3PO4:
AlCl3 + Na3PO4 = AlPO4 + 3 NaCl
El fosfato de aluminio AlPO4 se encuentra a menudo en la constitución de las cerámicas de alúmina.
La cerámica con alto contenido de alúmina es uno de los materiales que por su dureza se utiliza en aplicaciones en las que se requiere resistir altas cargas y condiciones severas.
Este tipo de cerámica es resistente a la corrosión, a ambientes con alta temperatura, a la presencia de vapor caliente o en atmósferas reductoras como la de monóxido de carbono (CO).
La cerámica de alúmina también posee baja conductividad eléctrica y térmica, por lo que se utiliza para hacer ladrillos refractarios y componentes aislantes de la electricidad.

Debido a que el fosfato de aluminio se forma a una temperatura mucho menor que la sílice SiO2, su producción es más económica, lo que constituye una ventaja en la fabricación de cerámicas adecuadas a servicios exigentes.
Se emplean alúmina Al2O3 y ácido fosfórico H3PO4 en medio acuoso.
El pH de formación preferido es 2-8, pues hay abundancia de especies de ácido fosfórico disueltas, como H2PO4– y HPO42-. A pH ácido la concentración de iones Al3+ es alta, provenientes de la disolución de la alúmina Al2O3.
En primer lugar se forma un gel de trihidrógeno difosfato de aluminio hidratado AlH3(PO4)2.H2O:
Al3+ + H2PO4– + HPO42- + H2O ⇔ AlH3(PO4)3.H2O
Sin embargo, llega un momento que el pH de la solución baja y se vuelve neutro, donde la alúmina Al2O3 presenta una baja solubilidad. En este momento la alúmina insoluble forma una capa sobre la superficie de las partículas impidiendo que continúe la reacción.
Por lo tanto es necesario aumentar la solubilidad de la alúmina y esto se logra calentando suavemente. Al calentar a 150 °C el gel continúa la reacción con alúmina Al2O3 liberando agua y se forma la berlinita cristalina (alfa-AlPO4).
Al2O3 + 2 AlH3(PO4)3.H2O → AlPO4 + 4 H2O
La berlinita une las partículas individuales y se forma la cerámica.
El AlPO4 se emplea como antiácido, como adsorbente, como tamiz molecular, como soporte de catalizadores y como recubrimiento para mejorar la resistencia a la corrosión en caliente. A continuación otras aplicaciones.
El fosfato de aluminio es un ingrediente de los concretos refractarios o concretos resistentes al calor.
Proporciona excelentes propiedades mecánicas y refractantes a estos concretos, tales como resistencia al calor. En el intervalo de temperatura entre 1400-1600 °C el concreto celular basado en fosfato de aluminio es uno de los materiales más eficientes como aislante térmico.
No requiere secado, su endurecimiento se alcanza mediante una reacción exotérmica autopropagada. Es posible preparar ladrillos de este material de cualquier forma y tamaño.
El fosfato de aluminio forma parte de los cementos dentales o materiales que se emplean para curar la dentadura cariada.
En los cementos dentales la alúmina se emplea como moderador de reacciones ácido-base, donde el efecto moderador se debe a la formación de fosfato de aluminio sobre las partículas de otros materiales.
Estos cementos presentan una muy alta resistencia a la compresión y a la tensión, la cual es debida a la presencia del fosfato de aluminio.
El AlPO4 ha sido usado desde hace muchos años en varias vacunas humanas para mejorar la respuesta inmunitaria del organismo. Se dice que el AlPO4 es un “adyuvante” de las vacunas. El mecanismo aún no se comprende bien.
Se sabe que el efecto inmunoestimulante del AlPO4 depende del proceso de adsorción del antígeno al adyuvante, es decir, de la forma en que se adhiere a este. Un antígeno es un compuesto que al entrar en el organismo genera la formación de anticuerpos para combatir una enfermedad específica.
Los antígenos se pueden adsorber al AlPO4 por interacciones electrostáticas o por la unión con ligandos. Se adsorben sobre la superficie del adyuvante.
Se cree además que el tamaño de las partículas de AlPO4 también tiene influencia. A menor tamaño de partícula la respuesta del anticuerpo es mayor y más duradera.
El AlPO4 se ha utilizado como ignífugo y evitar la combustión o quemado de ciertos polímeros.
La adición de AlPO4 a un polímero de polipropileno que ya posee un retardador de llama hace que se produzca un efecto sinérgico entre ambos retardadores, lo que significa que el efecto es mucho mayor que el de ambos ignífugos por separado.
Cuando el polímero es sometido a combustión o quemado en presencia de AlPO4, se forma un metafosfato de aluminio que penetra en la superficie carbonizada y llena los poros y grietas de esta.
Esto conduce a la formación de un escudo protector altamente eficiente para evitar el quemado o combustión del polímero. En otras palabras el AlPO4 sella la superficie carbonizada y evita que el polímero se queme.

- Abyzov, V.A. (2016). Lightweight Refractory Concrete Based on Aluminum-Magnesium-Phosphate Binder. Procedia Engineering 150 (2016) 1440-1445. Recuperado de sciencedirect.com.
- Wagh, A.S. (2016). Aluminum Phosphate Ceramics. In Chemically Bonded Phosphate Ceramics (Second Edition). Chapter 11. Recuperado de sciencedirect.com.
- Mei, C. et al. (2019). Aluminum Phosphate Vaccine Adjuvant: Analysis of Composition and Size Using Off-Line and In-Line Tools. Comput Struct Biotechnol J. 2019; 17: 1184-1194. Recuperado de ncbi.nlm.nih.gov.
- Qin, Z. et al. (2019). Synergistic barrier effect of aluminum phosphate on flame retardant polypropylene based on ammonium polyphosphate/dipentaerythritol system. Materials and Design 181 (2019) 107913. Recuperado de sciencedirect.com.
- Vrieling, H. et al. (2019). Stabilised aluminium phosphate nanoparticles used as vaccine adjuvant. Colloids and Surfaces B: Biointerfaces 181 (2019) 648-656. Recuperado de sciencedirect.com.
- Schaefer, C. (2007). Gastrointestinal drugs. Antacids. In Drugs During Pregnancy and Lactation (Second Edition). Recuperado de sciencedirect.com.
- Rouquerol, F. et al. (1999). Properties of Some Novel Adsorbents. In Adsorption by Powders and Porous Solids. Recuperado de sciencedirect.com.
