Isomerasas: procesos, funciones, nomenclatura y sub-clases
Las isomerasas son una clase de enzimas involucradas en el re-arreglo estructural o posicional de isómeros y estereoisómeros de diferentes moléculas. Están presentes virtualmente en todos los organismos celulares cumpliendo funciones en diversos contextos.
Las enzimas de esta clase actúan sobre un solo sustrato, a pesar de que algunas puedan estar asociadas covalentemente con cofactores, iones, entre otros. La reacción general, por lo tanto, puede verse como sigue:
X-Y → Y-X
Las reacciones catalizadas por estas enzimas implican un reordenamiento interno de los enlaces, que puede significar cambios en la posición de grupos funcionales, en la posición de dobles enlaces entre carbonos, entre otros, sin cambios en la fórmula molecular del sustrato.
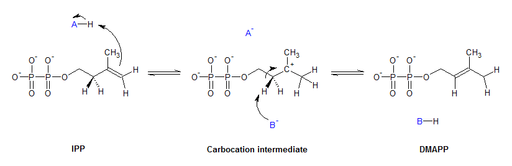
Las isomerasas cumplen diversas funciones en gran variedad de procesos biológicos, dentro de las cuales cabe incluir las rutas metabólicas, la división celular, la replicación del ADN, por citar algunas.
Las isomerasas fueron las primeras enzimas empleadas industrialmente para la producción de jarabes y otros alimentos azucarados, gracias a su capacidad de interconvertir los isómeros de diferentes tipos de carbohidratos.
Índice del artículo
Las isomerasas participan en múltiples procesos celulares vitales. Entre los más destacados están la replicación y empaquetamiento del ADN, catalizados por las topoisomerasas. Estos eventos son cruciales para la replicación del ácido nucleico, así como para su condensación antes de la división celular.
La glucólisis, una de las rutas metabólicas centrales en la célula, incluye al menos tres enzimas isómeras, a saber: la fosfoglucosa isomerasa, la triosa-fosfato isomerasa y la fosfoglicerato mutasa.
La conversión de UDP-galactosa en UDP-glucosa en la vía del catabolismo de la galactosa es conseguida por la acción de una epimerasa. En humanos esta enzima se conoce como la UDP-glucosa 4-epimerasa.
El plegamiento de proteínas es un proceso esencial para el funcionamiento de muchas enzimas en la naturaleza. La enzima proteína-disulfuro isomerasa asiste el plegamiento de proteínas que contienen puentes disulfuro al modificar la posición de los mismos en las moléculas que emplea como sustrato.
La función principal de las enzimas pertenecientes a la clase de las isomerasas puede verse como la de la transformación de un sustrato a través de un pequeño cambio estructural, con el fin de hacerlo susceptible a un procesamiento ulterior por enzimas aguas abajo en una ruta metabólica, por ejemplo.
Un ejemplo de isomerización es el cambio del grupo fosfato en posición 3 al carbono en posición 2 del 3-fosfoglicerato para convertirlo en 2-fosfoglicerato, catalizado por la enzima fosfoglicerato mutasa en la ruta glucolítica, con lo cual se genera un compuesto de mayor energía que es sustrato funcional de la enolasa.
La clasificación de las isomerasas sigue las reglas generales de la clasificación de las enzimas propuestas por la Comisión de Enzimas (Enzyme Commission) en el año 1961, en la cual cada enzima recibe un código numérico para su clasificación.
La posición de los números en dicho código indica cada una de las divisiones o categorías en la clasificación y estos números están precedidos por las letras “EC”.
Para las isomerasas el primer número representa la clase enzimática, el segundo denota el tipo de isomerización que realizan, y el tercero el sustrato sobre el que actúan.
La nomenclatura de la clase de las isomerasas es EC.5. Posee siete subclases, por lo que se encontrarán enzimas con el código desde EC.5.1 hasta el EC.5.6. Existe una sexta “sub-clase” de isomerasas conocida como “otras isomerasas”, cuyo código es EC.5.99, ya que incluye enzimas con diversas funciones isomerasas.
La denotación de las subclases se realiza principalmente de acuerdo con el tipo de isomerización que estas enzimas realizan. A pesar de ello, también pueden recibir nombres como racemasas, epimerasas, cis-trans-isomerasas, isomerasas, tautomerasas, mutasas o ciclo isomerasas.
Existen 7 clases de enzimas dentro de la familia de las isomerasas:
Catalizan la formación de mezclas racémicas basadas en la posición del carbono α. Pueden actuar sobre aminoácidos y derivados (EC.5.1.1), sobre grupos hidroxiácidos y derivados (EC.5.1.2), sobre carbohidratos y derivados (EC.5.1.3) y otros (EC.5.1.99).
Catalizan la conversión entre las formas isoméricas cis y trans de diferentes moléculas.
Estas enzimas se encargan de la isomerización de porciones internas en una misma molécula. Existen algunas que realizan reacciones de oxidorreducción, donde el donador y aceptor de electrones es la misma molécula, por lo que no se clasifican como oxidorreductasas.
Pueden actuar inter convirtiendo aldosas y cetosas (EC.5.3.1), sobre grupos ceto- y enol- (EC.5.3.2), cambiando la posición de dobles enlaces C-C (EC.5.3.3), de enlaces disulfuro S-S (EC.5.3.4) y otras “oxidorreductasas” (EC.5.3.99).
Estas enzimas catalizan los cambios de posición de diversos grupos dentro de la misma molécula. Se clasifican de acuerdo al tipo de grupo que “mueven”.
Están las Fosfomutasas (EC.5.4.1), las que transfieren grupos amino (EC.5.4.2), las que transfieren grupos hidroxilo (EC.5.4.3), y las que transfieren otros tipos de grupos (EC.5.4.99).
Catalizan la “eliminación” de un grupo que forma parte de una molécula, pero que no deja de estar unido covalentemente a la misma.
Pueden actuar alterando la conformación de polipéptidos (EC.5.6.1) o de ácidos nucleicos (EC.5.6.2).
Esta subclase reúne enzimas como la Tiocianato isomerasa y la 2-hidroxicromeno-2-carboxilato isomerasa.
- Adams, E. (1972). Amino Acids Racemases and Epimerases. The Enzymes, 6, 479–507.
- Boyce, S., & College, T. (2005). Enzyme Classification and Nomenclature. Encyclopedia of Life Sciences, 1–11.
- Cai, C. Z., Han, L. Y., Ji, Z. L., & Chen, Y. Z. (2004). Enzyme Family Classification by Support Vector Machines. Proteins: Structure, Function and Bioinformatics, 55, 66–76.
- Dugave, C., & Demange, L. (2003). Cis − Trans Isomerization of Organic Molecules and Biomolecules: Implications and Applications. Chemical Reviews, 103, 2475–2532.
- Encyclopedia Britannica. (2018). Retrieved March 3, 2019, from britannica.com
- Freedman, R. B., Hirst, T. R., & Tuite, M. F. (1994). Protein disulphide isomerase: building bridges in protein folding. TIBS, 19, 331–336.
- Murzin, A. (1996). Structural classification of proteins : new superfamilies Alexey G Murzin. Structural Classification of Proteins: New Superfamilies, 6, 386–394.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
- Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). (2019). Retrieved from qmul.ac.uk
- Thoden, J. B., Frey, P. A., & Holden, H. M. (1996). Molecular Structure of the NADH / UDP-glucose Abortive Complex of UDP-galactose 4-Epimerase from Escherichia coli: Implications for the Catalytic Mechanism. Biochemistry, 35, 5137–5144.
