Herencia holándrica: características, funciones de los genes, degeneración
La herencia holándrica es la transferencia de los genes ligados al cromosoma sexual Y desde los padres hasta los hijos. Estos genes se transfieren o se heredan intactos, es decir, no sufren recombinación, por lo que pueden considerarse como un solo haplotipo.
El cromosoma Y es uno de los dos cromosomas sexuales que determina el sexo biológico del embrión en los seres humanos y otros animales. Las hembras tienen dos cromosomas X, mientras que los machos tienen un cromosoma X y un cromosoma Y.
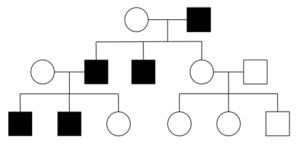
El gameto femenino transmite siempre un cromosoma X, mientras que los gametos masculinos pueden transmitir un cromosoma X o un cromosoma Y, es por ello que se dice que “determinan el sexo”.
Si el padre transmite un cromosoma X el embrión será genéticamente femenino, pero si el padre transmite un cromosoma Y el embrión será genéticamente masculino.
En el proceso de la reproducción sexual, los dos cromosomas sexuales se recombinan (intercambian información genética entre sí) combinando los rasgos transmitidos por ambos padres. Esta combinación ayuda a eliminar posibles rasgos defectuosos en la progenie.
No obstante, el 95 % del cromosoma Y es exclusivo de los organismos masculinos. Esta región es conocida comúnmente como “región específica masculina del Y”, y la misma no se recombina sexualmente con el cromosoma X durante la reproducción.
Es más, la mayoría de los genes en el cromosoma Y no se recombinan con ningún otro cromosoma durante la reproducción sexual, ya que estos se encuentran ligados entre sí, por lo que la mayoría son iguales en los parentales y en los descendientes.
Índice del artículo
- 1 Características del cromosoma Y
- 2 Funciones de los genes con herencia holándrica
- 3 Degeneración de los genes con herencia holándrica
- 4 Referencias
El cromosoma Y es el más pequeño de todos los cromosomas. En los mamíferos, este se compone de cerca de 60 mega bases y posee solo unos pocos genes. La región disponible para transcribirse (eucromatina) es de 178 tripletes, y el resto son pseudogenes o genes repetidos.
Los genes repetidos se encuentran en múltiples copias y en forma palindrómica, lo que quiere decir que se leen de igual forma en ambos sentidos como, por ejemplo, la palabra “nadan”; una secuencia palíndrome de ADN sería algo como como: ATAATA.
De las 178 unidades o tripletes expuestos para transcripción, se obtienen 45 proteínas únicas de este cromosoma. Algunas de estas proteínas están asociadas con el sexo y la fertilidad del individuo y otras no reproductivas son proteínas ribosómicas, factores de transcripción, etc.
La arquitectura del cromosoma Y se divide en dos regiones diferentes, un brazo corto (p) y un brazo largo (q). El brazo corto contiene de 10 a 20 genes diferentes, comprende cerca del 5 % de todo el cromosoma y puede recombinarse con el cromosoma X durante la meiosis.
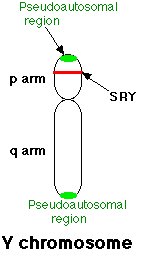
El brazo largo constituye cerca del 95% restante del cromosoma Y. Esta región es conocida como “región no recombinante” (NRY), aunque algunos investigadores sugieren que en dicha región si ocurre recombinación y la región debería llamarse “región específica masculina” (RMS).
Los genes pertenecientes a la región no recombinante del Y (el 95%) tienen herencia holándrica, ya que se encuentran localizados exclusivamente en dicho cromosoma y están unidos o ligados entre ellos. No hay recombinación en esta región y la tasa de mutación es muy baja.
En 1905, Nettie Stevens y Edmund Wilson observaron por primera vez que las células de los hombres y de las mujeres tenían una estructura cromosómica distinta.
Las células de las mujeres poseían dos copias del cromosoma grande X, entretanto los hombres solamente tenían una copia de este cromosoma X y, asociado a este, tenían un cromosoma mucho más pequeño, el cromosoma Y.
En las primeras 6 semanas de gestación, todos los embriones, bien sean genéticamente femeninos o masculinos, se desarrollan de la misma manera. De hecho, si lo siguieran haciendo hasta el parto darían lugar a un recién nacido físicamente femenino.
Todo esto cambia en los embriones masculinos por la acción del gen llamado “región de determinación sexual Y” localizado en el cromosoma Y. Esta deriva su nombre del inglés “sex-determining region Y” y se abrevia en la literatura como SRY.
El gen SRY fue descubierto en 1990 por Robin Lovell-Badge y Peter Goodfellow. Todos los embriones que poseen una copia activa de este gen desarrollan pene, testículos y barba (en la adultez).
Este gen funciona como un interruptor. Cuando se encuentra “encendido” activa la masculinidad y cuando está “apagado” da origen a individuos femeninos. Es el gen más estudiado del cromosoma Y y regula a muchos otros genes vinculados con el sexo de los individuos.
El gen Sox9 codifica para un factor de transcripción que es clave en la formación de los testículos y se expresa en conjunto con el gen SRY. El gen SRY activa la expresión de Sox9 para iniciar el desarrollo de las gónadas masculinas en muchos animales.
Todos los genes que se encuentran en el cromosoma Y, incluidos los que se transmiten a través de herencia holándrica, se encuentran en un cromosoma enano. Mientras que el cromosoma X posee más de 1000 genes, el cromosoma Y posee menos de 100.
El cromosoma Y alguna vez fue idéntico en tamaño al cromosoma X. Sin embargo, desde hace cerca de 300 millones de años ha disminuido su tamaño progresivamente, hasta el punto en que tiene menos información genética que cualquier otro cromosoma.
Además, el cromosoma X posee un par homólogo, ya que en las mujeres aparece en pares (XX) pero el cromosoma Y se encuentra únicamente en los hombres y no tiene un para homólogo. La ausencia de un par impide que el cromosoma Y pueda recombinar todas sus partes con un igual.
Esta ausencia de un par evita que los genes con herencia holándrica, exclusivos del cromosoma Y, puedan protegerse de las mutaciones y del deterioro genético normal de los ácidos nucleicos.
La ausencia de recombinación hace que cada mutación que ocurran en los genes ligados al cromosoma Y o con herencia holándrica se transmita intacta a los descendientes de sexo masculino, lo que puede significar una gran desventaja.
A pesar de que el cromosoma Y y sus genes se encuentran degenerados y vulnerables a las mutaciones, los científicos piensan que está lejos de dañarse por completo o desaparecer, ya que algunos genes de este cromosoma son importantes para la producción de espermatozoides.
Al estar implicado en la producción de espermatozoides, las mutaciones espontáneas que los dañen o inactiven se “auto seleccionan”, reduciendo la fertilidad del progenitor con dicha mutación, evitando que este pase sus genes a la descendencia.
- Bradbury, N. A. (2017). All Cells Have a Sex: Studies of Sex Chromosome Function at the Cellular Level. In Principles of Gender-Specific Medicine (pp. 269-290). Academic Press.
- Buchen, L. (2010). The fickle Y chromosome.
- Carvalho, A. B., Dobo, B. A., Vibranovski, M. D., & Clark, A. G. (2001). Identification of five new genes on the Y chromosome of Drosophila melanogaster. Proceedings of the National Academy of Sciences, 98(23), 13225-13230.
- Charlesworth, B., & Charlesworth, D. (2000). The degeneration of Y chromosomes. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 355(1403), 1563-1572.
- Colaco, S., & Modi, D. (2018). Genetics of the human Y chromosome and its association with male infertility. Reproductive biology and endocrinology, 16(1), 14.
- Gerrard, D. T., & Filatov, D. A. (2005). Positive and negative selection on mammalian Y chromosomes. Molecular biology and evolution, 22(6), 1423-1432.
- Hughes, J. F., Skaletsky, H., Pyntikova, T., Minx, P. J., Graves, T., Rozen, S. & Page, D. C. (2005). Conservation of Y-linked genes during human evolution revealed by comparative sequencing in chimpanzee. Nature, 437(7055), 100.
- Komori, S., Kato, H., Kobayashi, S. I., Koyama, K., & Isojima, S. (2002). Transmission of Y chromosomal microdeletions from father to son through intracytoplasmic sperm injection. Journal of human genetics, 47(9), 465-468.
- Malone, J. H. (2015). Widespread rescue of Y-linked genes by gene movement to autosomes. Genome biology, 16(1), 121.
- Papadopulos, A. S., Chester, M., Ridout, K., & Filatov, D. A. (2015). Rapid Y degeneration and dosage compensation in plant sex chromosomes. Proceedings of the National Academy of Sciences, 112(42), 13021-13026.
