Celdas electrolíticas: qué son, funcionamiento, tipos, aplicación, ejemplos
¿Qué son las celdas electrolíticas?
Las celdas electrolíticas son dispositivos utilizados para impulsar reacciones químicas de óxido reducción no espontáneas por medio del uso de energía eléctrica. En otras palabras, son celdas en las que se lleva a cabo el proceso de electrólisis, y de allí su nombre.
Se trata de un tipo particular de celdas electroquímicas. Esto quiere decir que son dispositivos en los que la especie que se oxida y la que se reduce no están en contacto directo, sino que se encuentran en compartimientos diferentes o reaccionan en electrodos separados físicamente.
Por esta razón, el intercambio de electrones entre la especie oxidante y reductora no se da de manera directa, sino a través de un conductor externo.
En el caso de que la reacción redox se dé de manera espontánea, es decir, sin ayuda de una fuente de energía externa, hablamos de celdas galvánicas.
Un ejemplo es una batería de auto. En cambio, si la reacción requiere una fuente de energía externa, se trata de una celda electrolítica.
Funcionamiento de las celdas electrolíticas
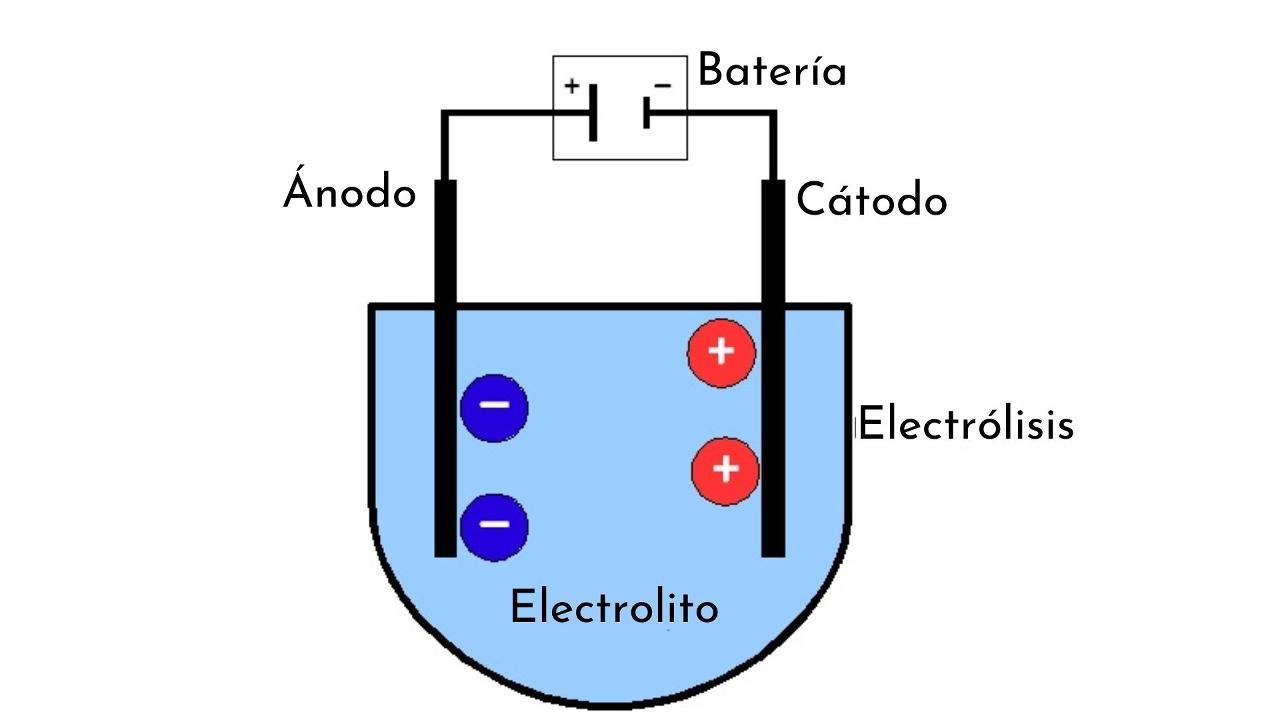
Toda celda electrolítica está formada por algunos elementos básicos que son:
- Dos electrodos denominados ánodo y cátodo.
- Una solución de la sustancia que pretendemos someter a electrólisis o, en su defecto, esta misma sustancia en estado líquido (por ejemplo, una sal fundida).
- Conductores eléctricos.
- Una fuente de energía eléctrica.
El proceso se lleva a cabo para reacciones que en condiciones normales no son espontáneas. Esto quiere decir que son reacciones de óxido reducción cuyo potencial de celda, dadas las concentraciones de las especies y las condiciones de temperatura y presión, es negativo.
Esto implica que los electrones no tienen la tendencia a ir desde la especie que queremos oxidar hacia la que queremos reducir, sino más bien en dirección contraria. Al aplicar un voltaje externo de signo contrario, podemos invertir el signo del potencial de celda, obligando a que ocurra la reacción.
Como toda reacción redox, la electrólisis ocurre en forma de dos semirreacciones que ocurren de manera separada en los dos electrodos. Estos se denominan cátodo y ánodo.
El cátodo
El cátodo es el electrodo conectado al polo negativo de la fuente de energía, y es donde ocurre la semirreacción de reducción. También es el electrodo al que se dirigen los iones positivos durante la electrólisis. De hecho, de allí es de donde proviene el nombre de los cationes.
Al representar el proceso de electrólisis en forma de un diagrama de celda, la semirreacción de reducción que ocurre en el cátodo se coloca siempre del lado derecho.
El ánodo
El ánodo es el electrodo opuesto al cátodo. Es decir, es el electrodo conectado al polo positivo de la fuente de energía y en el que ocurre la semirreacción de oxidación. También es el lugar al que se dirigen los iones con carga negativa (los aniones) y se representan siempre del lado izquierdo del diagrama de celda.
El flujo de electrones en la celda electrolítica
Al conectarse los electrodos a los polos opuestos de una fuente de energía que posea un potencial lo suficientemente alto, se cierra el circuito y se genera una corriente eléctrica. Esta corriente comienza en el ánodo, donde la especie reductora se oxida y pierde electrones.
Estos electrones fluyen a través del conductor eléctrico, impulsados por la diferencia de potencial hasta llegar al cátodo. Una vez en la superficie del cátodo, los electrones pasan a la especie oxidante, reduciéndola y completando la reacción redox.
Para que pueda continuar el flujo de electricidad, los iones en la solución o la sal fundida se mueven desde un electrodo al otro. Los cationes fluyen hacia el cátodo y los aniones hacia el ánodo.
A pesar de que parecieran ser dos corrientes en direcciones opuestas, en realidad ambas corrientes van en el mismo sentido. Esto se debe a que los portadores de carga que se mueven en direcciones opuestas también poseen cargas opuestas.
Tipos de celdas electrolíticas
Celdas electrolíticas de solución acuosa
Estas son las celdas más comunes. Consisten simplemente en dos electrodos de algún metal inerte sumergido en una disolución acuosa de la sal que queremos someter a electrólisis.
Solo sirven para reducir especies que tengan un potencial de reducción más positivo que el del hidrógeno, siempre que el pH sea neutro.
Por otro lado, únicamente sirven para oxidar especies que tengan un potencial de oxidación mayor que el del agua menos el sobrevoltaje del oxígeno.
Celdas electrolíticas de sales fundidas
En los casos en los que la especie que deseamos oxidar o reducir posea un potencial de oxidación o de reducción más bajo que el del agua, podemos llevar a cabo la electrólisis sobre la sal fundida. Esto requiere de una celda especial, como por ejemplo, la celda de Downs.
Aplicaciones de las celdas electrolíticas
Las celdas electrolíticas son de gran importancia en la industria. Algunas de las aplicaciones más importantes son:
Almacenamiento de energía
La electrólisis permite convertir la energía potencial eléctrica en energía potencial química. Las especies reducidas y oxidadas durante el proceso de electrólisis se convierten en especies nuevas capaces de reaccionar de manera espontánea, liberando nuevamente la energía invertida.
Producción de halógenos elementales
Los halógenos son de gran importancia industrial. Sin embargo, no se encuentran en la naturaleza de manera elemental, ya que son sustancias oxidantes muy reactivas. Por esta razón, muchos de los halógenos solo se pueden producir por medio de la electrólisis.
Producción de metales puros
Lo mismo que se puede decir de los halógenos también se puede decir de los metales más reactivos de la tabla periódica. Elementos como los metales alcalinos y el cobre solamente se pueden obtener por electrólisis de sales fundidas y de soluciones acuosas.
Ejemplos de celdas electrolíticas en la vida diaria
Electrólisis del fluoruro de sodio
La electrólisis del fluoruro de sodio fundido se utiliza industrialmente para la producción de sodio y flúor elementales. El flúor luego se puede emplear para obtener otros halógenos menos reactivos.
Electrólisis de nitrato de cobre
En la producción industrial de cobre, este se obtiene por medio de la electrólisis de soluciones acuosas de sus sales. Además, el cobre también se purifica por medio de la electrólisis, oxidándolo y disolviéndolo de un electrodo y depositándolo en el otro.
Electrólisis del agua
La electrólisis de una solución acuosa de ácido sulfúrico descompone el agua en oxígeno e hidrógeno y es una de las formas más fáciles de obtener este último elemento en forma pura.
Referencias
- Corinto – Química general (s. f.). Celdas Electrolíticas. Tomado de corinto.pucp.edu.pe.
- Ecured (s. f.). Celda Electrolítica. Tomado de ecured.cu.
- Luis Manuel (2014). Tipos de celdas electroquímicas. Tomado de prezi.com.
- Parada P., I. (2021). ¿Qué es una celda electrolítica? Tomado de yubrain.com.
