Mezcla racémica: quiralidad, ejemplos
Una mezcla racémica o racemato es aquella compuesta por dos enantiómeros en partes iguales y que por tanto es ópticamente inactiva. Esta actividad óptica se refiere a la capacidad de sus disoluciones de hacer rotar, en sentido horario o antihorario, un haz de luz polarizada que viaja a través de ellas en una dirección.
Un enantiómero tiene la capacidad de rotar la luz polarizada, digamos, hacia la izquierda (levógiro), por lo que su solución pura será ópticamente activa. Sin embargo, si a esta comienza a agregársele el enantiómero que rota la luz hacia la derecha (dextrógiro), su actividad óptica disminuirá hasta inactivarse.

Cuando sucede esto se dice que hay iguales cantidades de los enantiómeros levógiro y dextrógiro; si una molécula rota la luz polarizada hacia la izquierda, su efecto se cancelará inmediatamente cuando esta “tropiece” con otra molécula que la rote hacia la derecha. Y así sucesivamente. Por lo tanto, tendremos una mezcla racémica.
El primer avistamiento de la enantiomería fue hecho por el químico francés Louis Pasteur en 1848, quien estudiaba una mezcla de cristales enantioméricos del ácido tartárico (para aquel entonces llamado ácido racémico). Al provenir este ácido de las uvas utilizadas para la elaboración de vinos, esta mezcla terminó aplicándose de manera general para todas las moléculas.
Índice del artículo
En primer lugar para que haya una mezcla racémica tiene que haber dos enantiómeros (de ordinario), lo cual implica que ambas moléculas son quirales y que sus imágenes especulares no son superponibles. Un par de zapatos ilustra esto a la perfección: por más que se intente superponer el zapato izquierda sobre el derecho, nunca podrán calzar.
El zapato derecho, a decir, desvía la luz polarizada hacia la izquierda; mientras que el zapato izquierdo lo hace hacia la derecha. En una solución hipotética donde los zapatos son las moléculas, si solo hay zapatos derechos, quirales, esta será ópticamente activa. De igual modo sucederá si solo hay zapatos izquierdos en solución.
No obstante, si hay mil zapatos izquierdos mezclados con mil zapatos derechos, se tiene entonces una mezcla racémica, la cual es además ópticamente inactiva, ya que las desviaciones que sufre la luz en su interior se cancelan mutuamente.
Si en vez de zapatos fueran balones, objetos que son aquirales, sería imposible que existieran mezclas racémicas de estos, pues ni siquiera serían capaces de existir como pares de enantiómeros.

Regresando al ácido tartárico, su mezcla racémica fue la primera en conocerse. En la imagen superior se muestran sus dos enantiómeros, cada uno capaz de formar cristales con caras morfológicas de “izquierdas” o “derechas”. Pasteur, mediante la ayuda de un microscopio y un esfuerzo riguroso, logró separar entre sí estos cristales enantioméricos.
Los cristales de los enantiómeros L(+) y D(-) por separado, presentan actividad óptica al desviar la luz polarizada hacia la derecha o izquierda, respectivamente. Si ambos cristales en iguales proporciones molares se disuelven en agua, se obtendrá como resultado una mezcla racémica ópticamente inactiva.
Nótese que ambos enantiómeros poseen dos carbonos quirales (con cuatro sustituyentes diferentes). En el L(+), los OH se hallan detrás del plano formado por el esqueleto carbonado y los grupos COOH; mientras que en el D(-) estos OH están por encima de dicho plano.
Quienes sintetizan ácido tartárico obtendrán una mezcla racémica. Para separar el enantiómero L(+) del D(-), es necesario una resolución quiral, en la cual se hace reaccionar esta mezcla con una base quiral para producir sales diasteroisómeras, capaces de separarse luego por cristalización fraccionada.
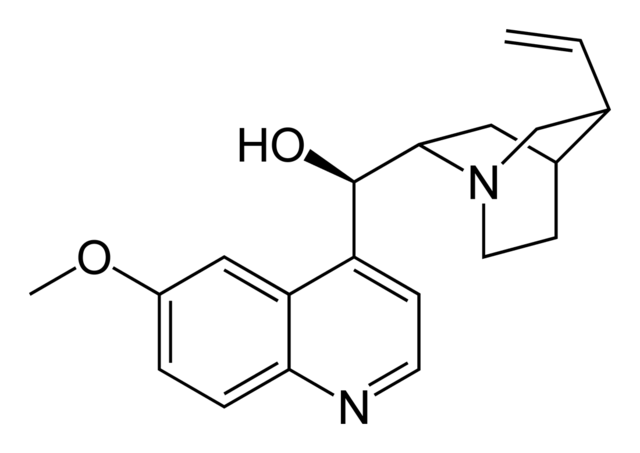
En el ejemplo anterior, para referirse a una mezcla racémica del ácido tartárico suele escribirse como ácido (±)-tartárico. Así, para el caso de la quinina (imagen superior) será (±)-quinina.
La isomería de la quinina es compleja: tiene cuatro carbonos quirales, dando lugar a dieciséis diasteroisómeros. Curiosamente, dos de sus enantiómeros (uno con el OH encima del plano y el otro por debajo de él), son en realidad diasteroisómeros, pues difieren en las configuraciones de sus otros carbonos quirales (los del biciclo con el átomo de N).
Ahora bien, es difícil de precisar cuáles de los estereoisómeros de la quinina desviarán la luz polarizada hacia la derecha o a la izquierda.
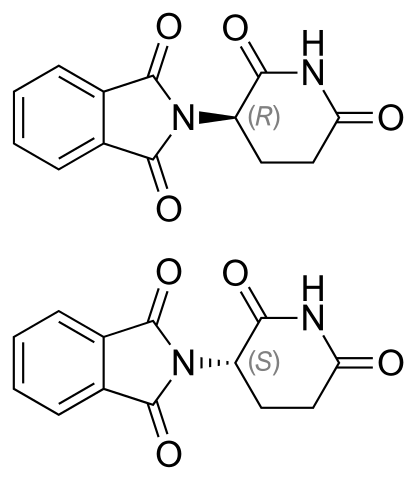
Arriba se muestran los enantiómeros de la talidomida. Solamente tiene un carbono quiral: el que está enlazado al nitrógeno que une ambos anillos (uno de ftalimida y el otro de gluteramida).
En el enantiómero R (con propiedades sedantes), el anillo de ftalimida (el de la izquierda) se orienta por encima del plano; mientras que en el enantiómero S (con propiedades mutagénicas), por debajo.
No se sabe al ojo por ciento cuál de los dos desvía la luz hacia la izquierda o la derecha. Lo que sí se sabe, es que una mezcla 1:1 o al 50% de ambos enantiómeros forma la mezcla racémica (±)-talidomida.
Si solo se quiere comercializar la talidomida como sedante hipnótico, es obligatorio someter su mezcla racémica a la resolución quiral ya mencionada, de tal modo que se obtenga el enantiómero R puro.

En la imagen superior se tiene el par de enantiómeros del 1,2-epoxipropano. El enantiómero R desvía la luz polarizada hacia la derecha, mientras que el S la desvía hacia la izquierda; es decir, el primero es el (R)-(+)-1,2-epoxipropano, y el segundo el (S)-(-)-1,2-epoxipropano.
La mezcla racémica de ellos dos, nuevamente, en una relación 1:1 o al 50%, viene a ser (±)-1,2-epoxipropano.

Arriba se muestra otra mezcla racémica formada por los dos enantiómeros del 1-Feniletilamina. El enantiómero R es el (R)-(+)-1-Feniletilamina, y el enantiómero S el (S)-(-)-1-Feniletilamina; uno tiene el grupo metilo, CH3, apuntando fuera del plano del anillo aromático, y el otro apuntando por debajo de este.
Nótese que cuando la configuración es R, a veces coincide con el hecho de que el enantiómero rote la luz polarizada hacia la derecha; sin embargo, no siempre aplica y no puede tomarse como una regla general.
Más importante que la existencia o no de las mezclas racémicas es la resolución quiral de las mismas. Esto aplica especialmente para los compuestos con efectos farmacológicos que dependen de dicha estereoisomería; es decir, un enantiómero puede ser beneficioso para el paciente, mientras que el otro puede afectarlo.
Es por eso que se recurren a estas resoluciones quirales para separar las mezclas racémicas en sus componentes, y así poder comercializarlos como fármacos puros libres de impurezas nocivas.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Steven A. Hardinger. (2017). Illustrated Glossary of Organic Chemistry: Racemic Mixture. Department of Chemistry & Biochemistry, UCLA. Recuperado de: chem.ucla.edu
- Nancy Devino. (2019). Racemic Mixture: Definition & Example. Study. Recuperado de: study.com
- James Ashenhurst. (2019). Stereochemistry and Chirality: What’s a Racemic Mixture? Recuperado de: masterorganicchemistry.com
- John C. Leffingwell. (2003). Chirality & Bioactivity I.: Pharmacology. [PDF]. Recuperado de: leffingwell.com
