Holoenzima: características, funciones y ejemplos
Una holoenzima es una enzima que está formada por una parte proteica llamada apoenzima combinada con una molécula no proteica llamada cofactor. Ni la apoenzima ni el cofactor son activos cuando están por separado; es decir, para poder funcionar tienen que acoplarse.
Así, las holoenzimas son las enzimas combinadas y, en consecuencia, son catalíticamente activas. Las enzimas son un tipo de biomoléculas cuya función es básicamente incrementar la velocidad de las reacciones celulares. Algunas enzimas necesitan la ayuda de otras moléculas, llamadas cofactores.
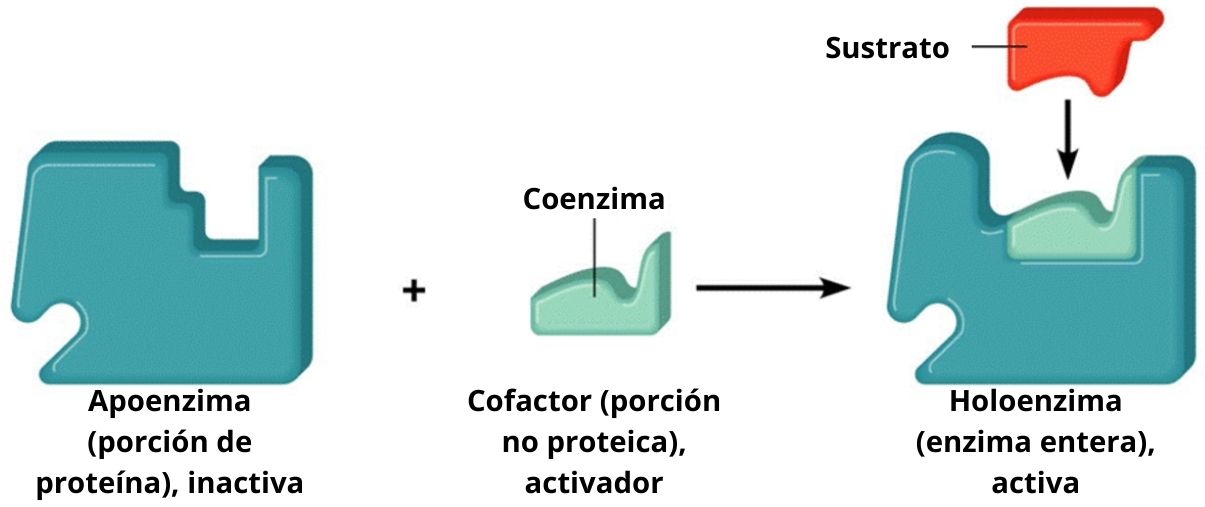
Los cofactores se complementan con las apoenzimas y forman una holoenzima activa que realice la catálisis. Aquellas enzimas que requieren un cofactor particular se conocen como enzimas conjugadas. Estas tienen dos componentes principales: el cofactor, que puede ser un ión metálico (inorgánico) o una molécula orgánica; la apoenzima, parte proteica.
Índice del artículo
Las apoenzimas son la parte proteica del complejo, y los cofactores pueden ser iones o moléculas orgánicas.
Hay diversos tipos de cofactores que ayudan a formar las holoenzimas. Algunos ejemplos son las coenzimas y vitaminas comunes, por ejemplo: vitamina B, FAD, NAD+, vitamina C t coenzima A.
Algunos cofactores con iones metálicos, por ejemplo: cobre, hierro, zinc, calcio y magnesio, entre otros. Otra clase de cofactores son los llamados grupos prostéticos.
Los cofactores se pueden unir a las apoenzimas con distinta intensidad. En algunos casos la unión es débil y temporal, mientras que, en otros casos la unión es tan fuerte que es permanente.
En los casos donde la unión es temporal, cuando el cofactor se elimina de la holoenzima, esta se convierte de nuevo en apoenzima y dejar de estar activa.
La holoenzima es una enzima lista para ejercer su función catalítica; es decir, para acelerar ciertas reacciones químicas que se generan en distintos ámbitos.
Las funciones pueden variar según la acción específica de la holoenzima. Entre las más importantes destaca la ADN polimerasa, cuya función es garantizar que el copiado del ADN se haga de forma correcta.
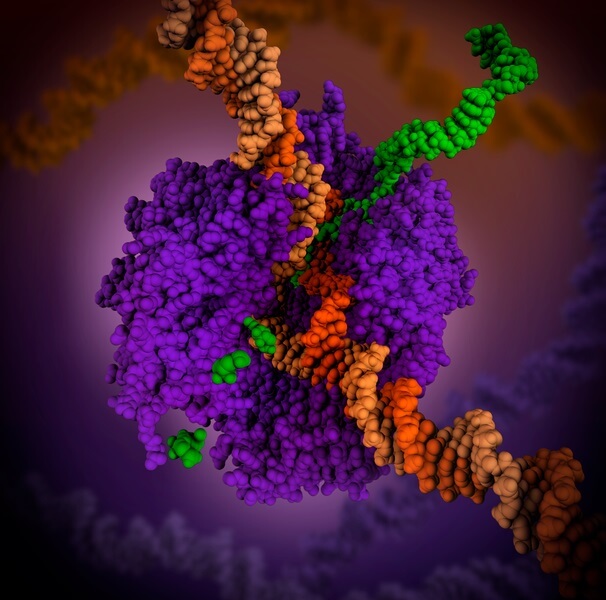
La ARN polimerasa es una holoenzima que cataliza la reacción de síntesis del ARN. Esta holoenzima es necesaria para construir cadenas de ARN a partir de cadenas molde de ADN que funcionan como plantillas durante el proceso de la transcripción.
Su función es agregar ribonucleótidos en el extremo 3 de una molécula creciente de ARN. En procariotas, la apoenzima de la ARN polimerasa necesita un cofactor llamado sigma 70.
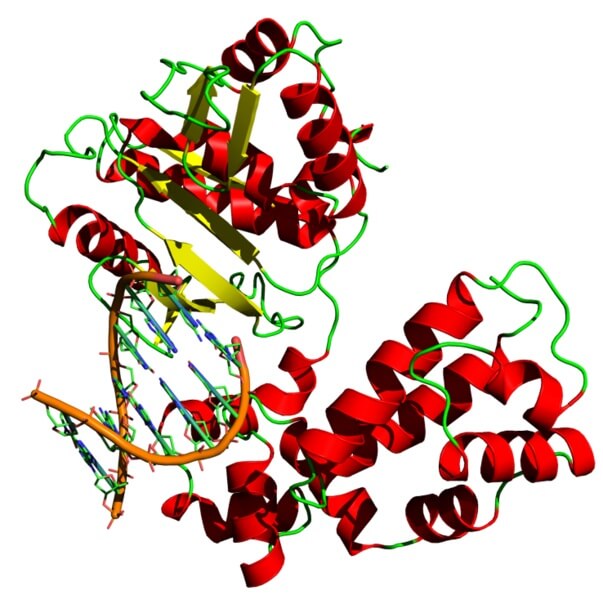
La ADN polimerasa es también una holoenzima que cataliza la reacción de polimerización del ADN. Esta enzima cumple una función muy importante para las células porque es la encargada de replicar la información genética.
La ADN polimerasa necesita un ion con carga positiva, normalmente magnesio, para poder realizar su función.
Hay varios tipos de ADN polimerasa: la ADN polimerasa III es una holoenzima que tiene dos enzimas centrales (Pol III), cada una compuesta de tres subunidades (α, ɛ y θ), una pinza deslizante que tiene dos subunidades beta y un complejo de fijación de carga que tiene múltiples subunidades ( δ, τ, γ, ψ, y χ).

La anhidrasa carbónica, también llamada deshidratasa de carbonato, pertenece a una familia de holoenzimas que catalizan la conversión rápida del dióxido de carbono (CO₂) y el agua (H20) en bicarbonato (H2CO3) y protones (H+).
La enzima requiere un ion de zinc (Zn+2) como cofactor para poder realizar su función. La reacción catalizada por la anhidrasa carbónica es reversible, por esta razón su actividad se considera importante dado que ayuda a mantener el equilibrio ácido-base entre la sangre y los tejidos.
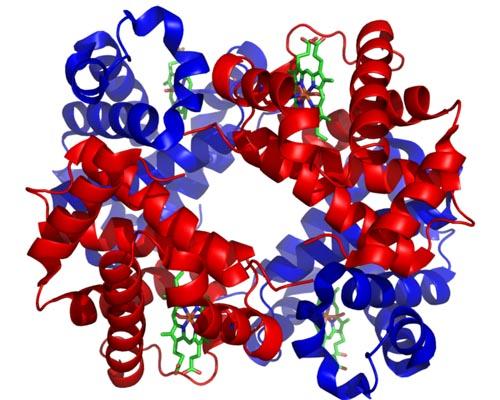
La hemoglobina es una holoenzima muy importante para el transporte de gases en los tejidos animales. Esta proteína presente en los glóbulos rojos contiene hierro (Fe+2), y su función es transportar el oxígeno desde los pulmones hacia otras áreas del cuerpo.
La estructura molecular de la hemoglobina es un tetrámero, lo cual quiere decir que está compuesta por 4 cadenas polipeptídicas o subunidades.
Cada subunidad de esta holoenzima contiene un grupo hemo, y cada grupo hemo contiene un átomo de hierro que puede unirse a las moléculas de oxígeno. El grupo hemo de la hemoglobina es su grupo prostético, necesario para su función catalítica.

La citocromo oxidasa es una enzima que participa en los procesos de obtención de energía, los cuales se llevan a cabo en las mitocondrias de casi todos los seres vivos.
Es una holoenzima compleja que requiere la colaboración de ciertos cofactores, iones de hierro y cobre, para poder catalizar la reacción de transferencia de electrones y producción de ATP.
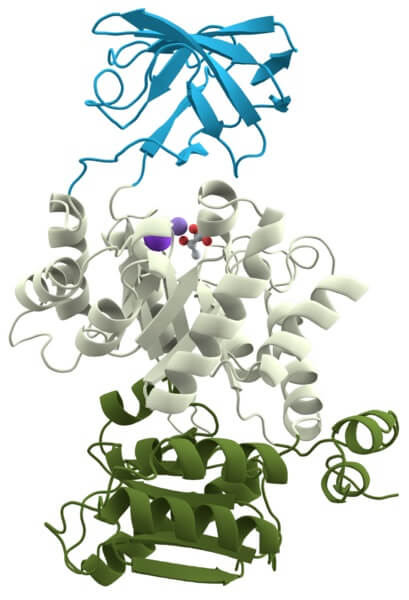
La piruvato quinasa es otra holoenzima importante para todas las células, debido a que participa en una de las rutas metabólicas universales: la glucólisis.
Su función es catalizar la transferencia de un grupo fosfato de una molécula llamada fosfoenolpiruvato a otra molécula llamada adenosina difosfato, para formar ATP y piruvato.
La apoenzima requiere cationes de potasio (K`) y magnesio (Mg+2) como cofactores para formar la holoenzima funcional.
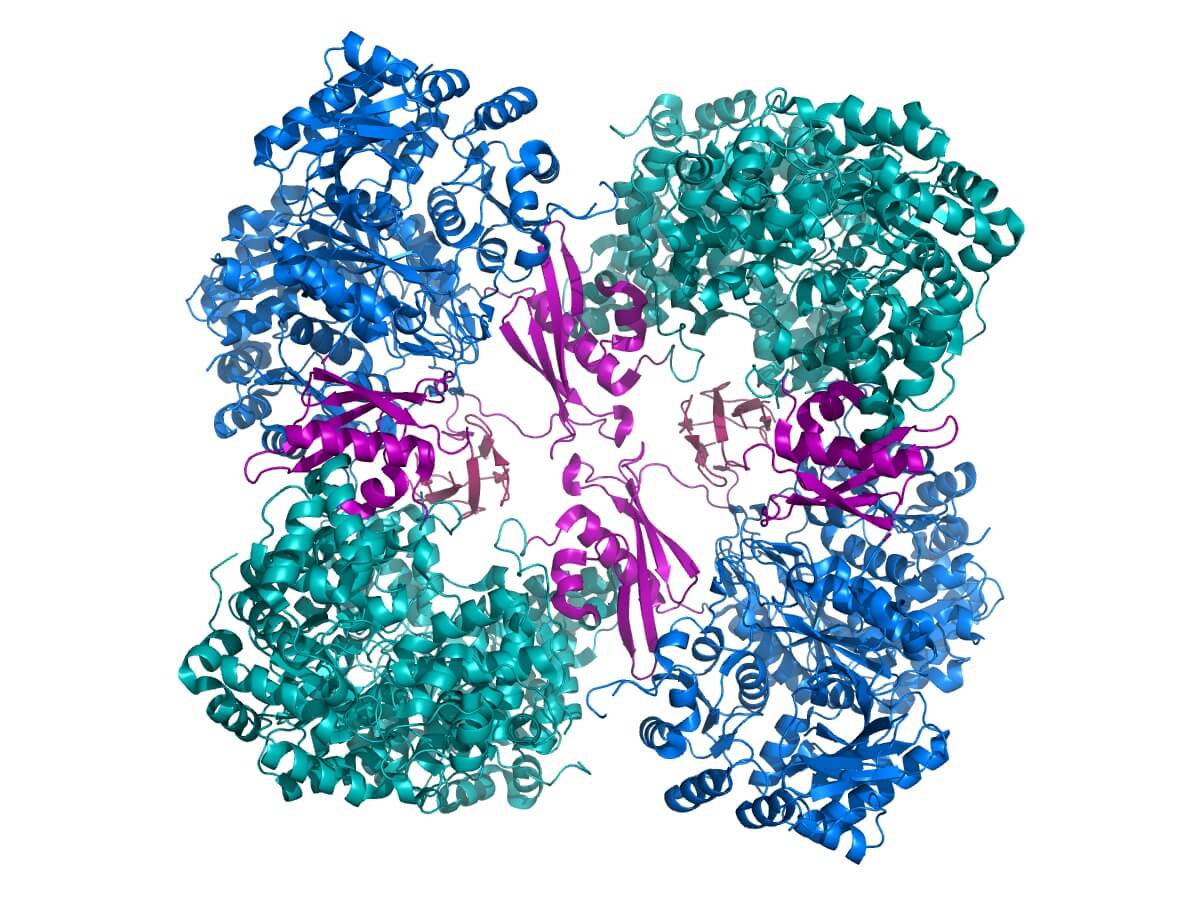
Otro ejemplo importante lo constituye la piruvato carboxilasa, una holoenzima que cataliza la transferencia de un grupo carboxilo a una molécula de piruvato. Así, el piruvato se convierte en oxalacetato, un intermediario importante en el metabolismo.
Para ser funcionalmente activa, la apoenzima de la piruvato carboxilasa requiere un cofactor llamado biotina.
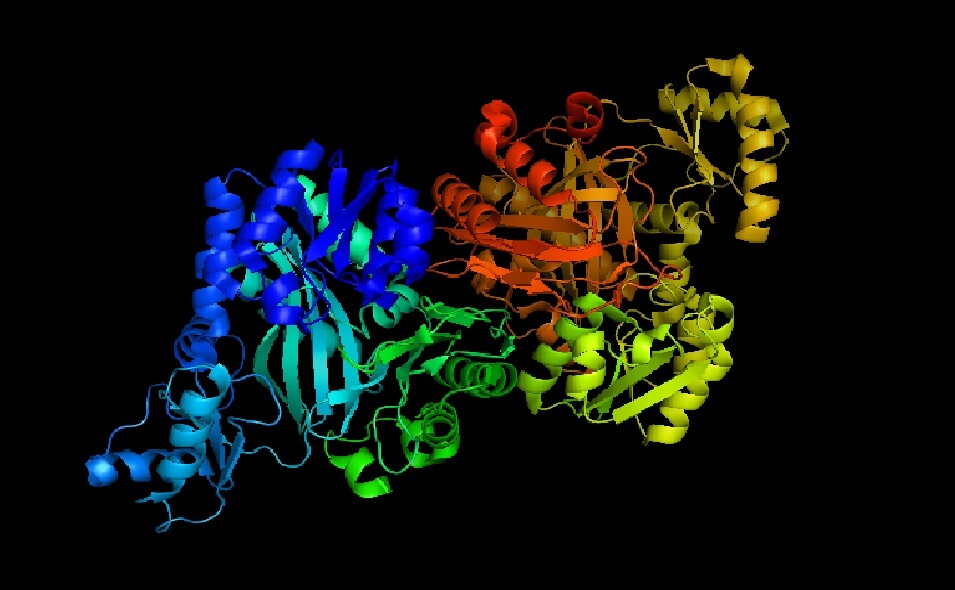
La acetil-CoA carboxilasa es una holoenzima cuyo cofactor, como lo indica su nombre, es la coenzima A.
Cuando la apoenzima y la coenzima A se acoplan, la holoenzima está catalíticamente activa para realizar su función: transferir un grupo carboxilo al acetil-CoA para convertirlo en malonil coenzima A (malonil-CoA).
La acetil-CoA realiza funciones importantes tanto en células animales como en células vegetales.
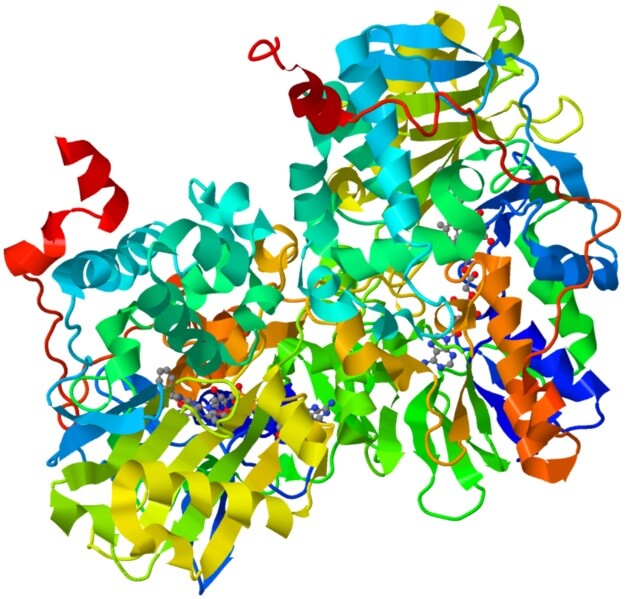
Esta es una holoenzima importante en el sistema nervioso humano, su función es promover la degradación de ciertos neurotransmisores.
Para que la monoamina oxidasa sea catalíticamente activa, necesita unirse covalentemente a su cofactor, el dinucleótido de flavina y adenina (FAD).
La lactato deshidrogenasa es una holoenzima importante para todos los seres vivos, particularmente en los tejidos que consumen mucha energía, como corazón, cerebro, hígado, músculo esquelético, pulmones, entre otros.
Esta enzima requiere la presencia de su cofactor, el dinucleótido de nicotinamida y adenina (NAD), para poder catalizar la reacción de conversión de piruvato a lactato.
La catalasa es una holoenzima importante en la prevención de la toxicidad celular. Su función es descomponer el peróxido de hidrógeno, producto del metabolismo celular, en oxígeno y agua.
La apoenzima de la catalasa requiere de dos cofactores para activarse: un ion de manganeso y un grupo prostético HEMO, similar al de la hemoglobina.
- Athappilly, F. K., & Hendrickson, W. A. (1995). Structure of the biotinyl domain of acetyl-coenzyme A carboxylase determined by MAD phasing. Structure, 3(12), 1407–1419.
- Berg, J., Tymoczko, J., Gatto, G. & Strayer, L. (2015). Biochemistry (8th ed.). W. H. Freeman and Company.
- Fegler, J. (1944). Function of Carbonic Anhydrase in Blood. Nature, 137–38.
- Gaweska, H., & Fitzpatrick, P. F. (2011). Structures and mechanism of the monoamine oxidase family. Biomolecular Concepts, 2(5), 365–377.
- Gupta, V., & Bamezai, R. N. K. (2010). Human pyruvate kinase M2: A multifunctional protein. Protein Science, 19(11), 2031–2044.
- Jitrapakdee, S., St Maurice, M., Rayment, I., Cleland, W. W., Wallace, J. C., & Attwood, P. V. (2008). Structure, mechanism and regulation of pyruvate carboxylase. Biochemical Journal, 413(3), 369–387.
- Muirhead, H. (1990). Isoenzymes of pyruvate kinase. Biochemical Society Transactions, 18, 193–196.
