Inmunoglobulina M (IgM): qué es, estructura, funciones, valores
¿Qué es la inmunoglobulina M?
La inmunoglobulina M o IgM es un anticuerpo producido por las células o linfocitos B del sistema inmune de muchos animales. Puede hallarse unida a la membrana plasmática de estas células o puede ser secretada en forma de complejo hacia el torrente sanguíneo y la linfa, por lo que participa activamente en los procesos de inmunidad humoral o adaptativa.
Así como las demás inmunoglobulinas (IgG, IgA, IgD e IgE), la inmunoglobulina M posee una estructura tal que la hace capaz de unirse casi a cualquier tipo de antígeno, incluyendo proteínas, glicoproteínas, polisacáridos y otros carbohidratos, ácidos nucleicos, lípidos, entre otros.
La IgM es uno de los primeros anticuerpos producidos durante el curso de una infección bacteriana y durante el desarrollo neonatal.
Fue el primero en purificarse con una homogeneidad significativa y puesto que se trata de un anticuerpo poli reactivo, es decir, que tiene la habilidad de unirse a dos o más antígenos simultáneamente incluso si son diferentes en naturaleza, es muy importante para el combate de diferentes patologías.
Como “anticuerpos naturales”, es decir, aquellos que se producen sin una inmunización previa intencional, estas inmunoglobulinas no solo pueden unirse a antígenos bacterianos, sino también a virus, protozoarios, parásitos metazoarios y hongos, así como a ciertos componentes del plasma sanguíneo.
Estructura de la IgM
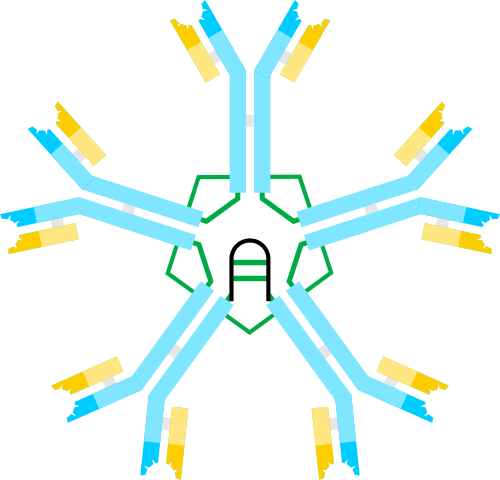
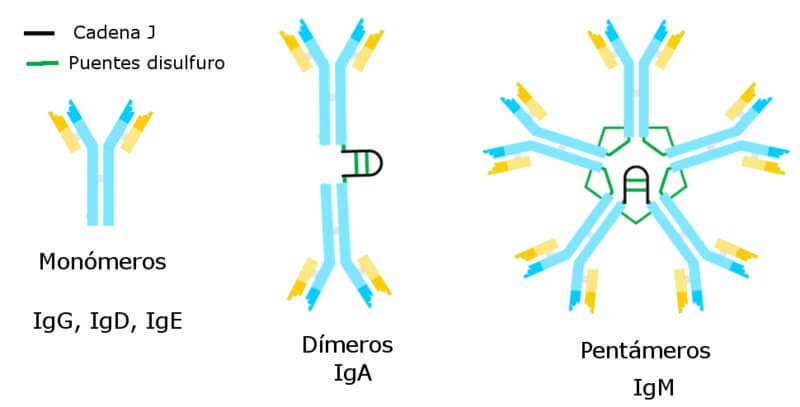
Análogamente a lo que se ha descrito para la inmunoglobulina G, uno de los anticuerpos más abundantes en el plasma sanguíneo, y las demás inmunoglobulinas, los monómeros de la inmunoglobulina M tienen una estructura que podría describirse como en forma de “Y”, aunque este anticuerpo suele encontrarse en el plasma como pentámero.
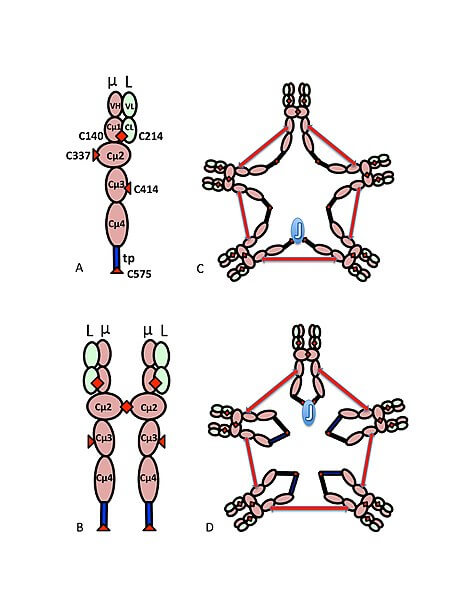
Cada una de las 5 subunidades de esta glicoproteína pentamérica está formada por cuatro cadenas: dos cadenas pesadas idénticas “μ” de 55 kDa y dos cadenas ligeras idénticas de 25 kDa que, al asociarse en la forma pentamérica soluble, pesan alrededor de 970 kDa.
Las cadenas ligeras se unen solo a una porción de las cadenas pesadas gracias a la formación de puentes disulfuro entre residuos de cisteína.
Cuando estas moléculas son hidrolizadas enzimáticamente, dicha reacción resulta en dos fragmentos, uno de ellos “homogéneo”, conocido como la región constante o Fc, y el otro conocido como la región variable o Fab2 (también llamada región hipervariable), capaz de unirse a un antígeno.
La secuencia aminoacídica de la cadena pesada de la inmunoglobulina M, especialmente la de la región constante, es la que define su identidad, así como define la de los demás isotipos de anticuerpos que han sido definidos en los animales, que juntos conforman a la superfamilia de inmunoglobulinas.
La estructura terciaria de las cadenas pesadas y ligeras de este anticuerpo consiste en láminas β-plegadas conectadas entre sí a través de lazos de longitud variable que pueden estar estabilizados por puentes disulfuro.
En la forma pentamérica, cada monómero de la IgM interactúa con una cadena polipeptídica de unión llamada cadena J, de 15 kDa y que permite la formación de la estructura formada por los 5 monómeros.
Ya que cada monómero tiene la capacidad de unirse a dos moléculas antigénicas idénticas, un pentámero de IgM puede unirse a 10 antígenos simultáneamente.
Funciones
La inmunoglobulina M participa en la respuesta inicial contra antígenos bacterianos, por lo que usualmente es el primer anticuerpo secretado por las células B activadas durante la respuesta inmune.
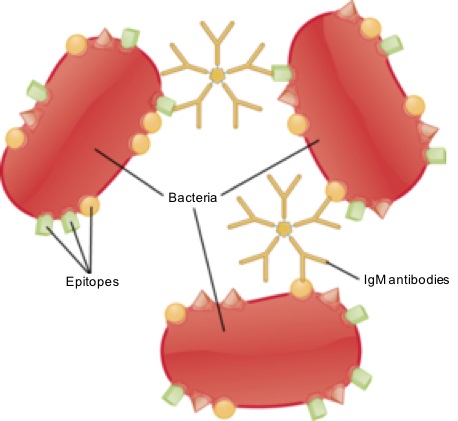
Ya que su estructura soluble es capaz de unirse a gran cantidad de moléculas de antígeno, esta tiene la capacidad de agregar o aglutinar partículas antigénicas pertenecientes a células como los glóbulos rojos, las bacterias, los protozoarios y otras.
Este anticuerpo es muy importante para la neutralización temprana de toxinas bacterianas y también es efectivo en la mediación de la actividad del sistema de complemento, promoviendo la rápida “opsonización” de las partículas antigénicas.
Su forma monomérica se encuentra generalmente unida a la membrana plasmática de los linfocitos B “vírgenes”, así como ocurre con la inmunoglobulina D, y se ha determinado que gran parte del repertorio de células B de los neonatos corresponde a linfocitos con IgM en su membrana.
También hay que destacar el hecho de que es la primera inmunoglobulina producida por las células B “vírgenes” en los fetos durante la gestación, posterior a las primeras estimulaciones antigénicas.
Aunque en baja concentración, la inmunoglobulina M ha sido hallada en las secreciones de los animales mamíferos, hecho que sugiere que participa también en la protección inmunológica de las mucosas corporales.
Valores altos (significado) de IgM
Se considera que una persona tiene valores altos de una inmunoglobulina cuando los estudios arrojan valores por encima del rango normal.
Altos valores de inmunoglobulina M plasmática pueden ser indicativos de la exposición reciente a un antígeno, así como un estadio temprano de hepatitis viral y otras condiciones patológicas como:
– mononucleosis,
– artritis reumatoide,
– macroglobulinemia de Waldenstrom,
– síndrome nefrótico (daños renales)
– desarrollo de infecciones causadas por agentes parasíticos
Otro motivo por el cual se pueden obtener altos valores de IgM en el suero es la existencia de síndromes de “Hiper IgM” (HIGM). Los pacientes con este síndrome son más susceptible al padecimiento de infecciones recurrentes e incluso a diferentes tipos de cáncer, puesto que el mismo cursa con una caída drástica de los niveles de IgG.
Valores bajos (significado)
La existencia de algunas patologías significativas como los mielomas múltiples, algunos tipos de leucemias y ciertas enfermedades inmunológicas hereditarias se ha correlacionado con bajos niveles de inmunoglobulina M en el suero.
Los pacientes con el síndrome de deficiencia ligado al cromosoma X de Wiskott-Aldrich pueden presentar bajos niveles de IgM, empero, un pequeño aumento en los niveles de las otras cuatro inmunoglobulinas puede compensar dicha condición.
Bajos niveles de IgM pueden indicar condiciones más severas como una deficiencia de inmunoglobulinas, lo que puede tener serias implicaciones para la salud, especialmente durante la exposición a antígenos nuevos o durante el curso de ciertas enfermedades.
Estas deficiencias pueden tener muchas causas, desde errores en los sistemas de reconocimiento antigénico hasta defectos en la producción de anticuerpos por parte de los linfocitos B.
Niveles tan bajos como 40 mg/dL han sido reportados para aquellos pacientes con deficiencias selectivas de IgM, que consisten en una forma “rara” de disgammaglobulinemia.
Valores normales
El rango normal de concentración plasmática de la inmunoglobulina M es sumamente variable y depende, entre muchas cosas, de la edad. Según los diferentes grupos etarios, este anticuerpo está en una concentración de:
– 26-122 mg/dL entre 0 y 5 meses
– 32-132 mg/dL entre 5 y 9 meses
– 40-143 mg/dL entre 9 y 15 meses
– 46-152 mg/dL entre 15 y 24 meses
– 37-184 mg/dL entre 2 y 4 años
– 27-224 mg/dL entre 4 y 7 años
– 35-251 mg/dL entre 7 y 10 años
– 41-255 mg/dL entre 10 y 13 años
– 45-244 mg/dL entre 13 y 16 años
– 49-201 mg/dL entre 16 y 18 años
– 37-286 mg/dL en adultos mayores a 18 años, aunque algunos textos indican que el rango está entre 45 y 150 mg/dL, entre 45 y 250 mg/dL o entre 60 y 360 mg/dL
Es importante mencionar que estos valores de concentración de la IgM son más o menos 10 veces menores a los de otras inmunoglobulinas importantes como la IgG, por ejemplo.
