¿Qué es la periodicidad química?
La periodicidad química es una tendencia o patrón que exhiben los elementos químicos para un conjunto de sus propiedades químicas y físicas. Viene a ser una especie de parentesco, la cual fue guía fundamental para que los padres de la química organizaran y clasificaran todos los elementos en la hoy conocida tabla periódica.
Los 118 elementos existentes (entre naturales y artificiales) guardan, en distinta medida, una relación entre sí que les define en familias o grupos. Al principio esto permitió describir las reactividades de los elementos, así como el tipo de compuestos que forman; y aún mejor, predecir las propiedades de aquellos que todavía no se habían descubierto.
Luego, mientras transcurría el siglo XX y progresaba la física, se correlacionaron estas propiedades con la estructura electrónica del átomo. Es así que los electrones marcan la periodicidad química en lo que respecta a los elementos, pero no tanto para sus isótopos y estabilidades relativas.
Gracias a la periodicidad química es posible entender por qué los elementos están posicionados en un mismo grupo de la tabla periódica. Asimismo, posibilita la predicción de las propiedades químicas, e inclusive físicas, entre elementos de distintas masas atómicas.
Índice del artículo
- 1 Patrones y grupos
- 2 Energía de ionización
- 3 Hidruros del bloque p
- 4 Moléculas de halógenos
- 5 Óxidos y sulfuros
- 6 Hidrocarburos y silanos
- 7 Referencias

La periodicidad química se observa, como es de esperarse, en las propiedades periódicas. Estas se caracterizan por la tendencia de sus valores a medida que se evalúan a lo largo de un período o grupo de la tabla periódica.
Se pueden escoger para propósitos de comparación un zigzag, una sierra o una montaña escarpada: con subidas y bajadas. Es decir, las propiedades periódicas oscilan teniendo mínimos y máximos para determinados elementos. Y las posiciones relativas de estos elementos corresponden, brillantemente, con la ubicación en sus respectivos grupos.
Es por eso que la periodicidad química resulta útil analizarla en función de los grupos; sin embargo, los períodos son esenciales para una visión completa de la tendencia.
Se verá con los siguientes ejemplos de periodicidad en química, que no solo esta reluce en las propiedades periódicas, sino también en los compuestos inorgánicos e, inclusive, orgánicos.
La energía de ionización, EI, es una de las propiedades periódicas más resaltantes. Cuanto más grande sea el átomo de un elemento, más fácil será removerle uno de sus últimos electrones; es decir, los de valencia. Por lo tanto: átomos con radios pequeños tendrán EI grandes, mientras que átomos con radios grandes, tendrán EI pequeñas.
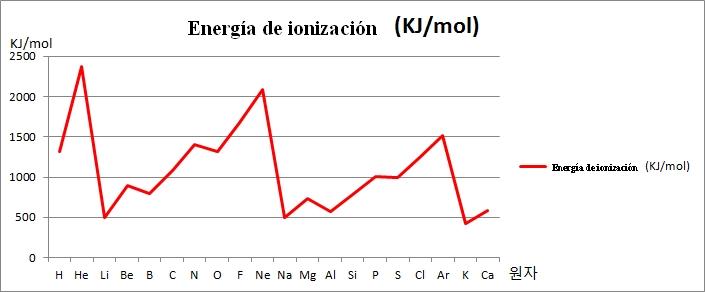
Nótese por ejemplo en la imagen de arriba que los elementos Li, Na y K, tienen las menores EI, razón por la que se ubican en los valles o fondos de la gráfica. Mientras, los elementos He, Ne y Ar, se encuentran en las cumbres o puntos más altos, ya que sus EI son muy grandes en relación a los otros elementos.
Los elementos Li, Na y K pertenecen al grupo de los metales alcalinos, caracterizados por sus bajas EI. Por otro lado, los elementos He, Ne y Ar corresponden a los gases nobles, con EI muy altas, debido a que sus átomos son los más pequeños entre todos los elementos para un mismo período de la tabla periódica.
Así pues, la periodicidad química indica que EI disminuye bajando por un grupo, pero aumenta recorriendo un período de izquierda a derecha.
Un ejemplo de la periodicidad química fuera de las propiedades periódicas lo vemos en los hidruros de los elementos del bloque p.
Por ejemplo, el grupo 15 está compuesto por los elementos N, P, As, Sb y Bi. Si se sabe que el amoníaco, NH3, tiene al nitrógeno con un número de oxidación de +3, entonces cabe esperarse, por simple periodicidad, que los restantes elementos también presenten hidruros similares. Y efectivamente así es: NH3, PH3, AsH3, SbH3 y BiH3.
Otro caso parecido ocurre con el grupo 16. El hidruro del oxígeno es H2O, el agua. Es de esperarse, de nuevo, que los elementos S, Se, Te y Po posean hidruros con iguales fórmulas, pero con propiedades abismalmente diferentes. Y así es: H2S, H2Se, H2Te y H2Po. Esto se debe a la periodicidad química.
Quizás el ejemplo más impresionante lo comprenden los hidruros de carbono, silicio y germanio. El hidruro de carbono es CH4, y el del silicio, SiH4. El germanio, predicho por Mendeleev con el nombre de eka-silicio (Es), debía de tener por periodicidad un hidruro con fórmula GeH4; predicción que terminó por confirmarse tras su descubrimiento y posteriores estudios.
Si se sabe que el flúor se encuentra en estado elemental como molécula F2, entonces es de suponerse que los otros halógenos (Cl, Br, I y At) también se encuentren formando moléculas diatómicas. Y así es, siendo las moléculas Cl2, Br2 y I2 las más conocidas.
Análogamente como se mencionó con los hidruros del bloque p, los óxidos y sulfuros para elementos de un mismo grupo muestran una suerte de correspondencia en sus respectivas fórmulas químicas. Por ejemplo, el óxido de litio es Li2O, siendo los óxidos para los demás metales alcalinos o del grupo 1: Na2O, K2O, Rb2O y Cs2O.
Esto se debe a que en todos ellos se tiene a los metales con un número de oxidación de +1, interaccionando con un anión O2-. Igual sucede con sus sulfuros: Li2S, Na2S, etc. Para el caso de los metales alcalinotérreos o del grupo 2, las fórmulas de sus óxidos y sulfuros son, respectivamente: BeO y BeS, MgO y MgS, CaO y CaS, SrO y SrS, BaO y BaS.
Esta periodicidad aplica también (en parte) para los óxidos de los elementos del bloque p: CO2, SiO2, GeO2, B2O3, Al2O3, Ga2O3, etc. Sin embargo, para los elementos del bloque d u otros del bloque p, dicha periodicidad se vuelve más complicada a causa de los mayores números de oxidación posibles para un mismo elemento.
Por ejemplo, el cobre y la plata pertenecen al grupo 11. Uno tiene dos óxidos: CuO (Cu2+) y Cu2O (Cu+); mientras que el otro apenas tiene solo uno: AgO (Ag+).
Tanto el carbono como silicio tienen la capacidad de formar enlaces C-C o Si-Si, respectivamente. Los enlaces C-C son mucho más estables, por lo que las estructuras de los hidrocarburos pueden llegar a ser desproporcionadamente más numerosas y variadas que las de sus homólogos silanos.
Esta conclusión se debe nuevamente a la periodicidad química. Por ejemplo, el etano, CH3CH3 o C2H6 tiene su homólogo el disilano, SiH3SiH3 o Si2H6.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (26 de agosto de 2020). Periodicity Definition in Chemistry. Recuperado de: thoughtco.com
- E. V. Babaev, & Ray Hefferlin. (s.f.). Concept of Chemical Periodicity:
from Mendeleev Table to Molecular Hyper-Periodicity Patterns. Recuperado de: chem.msu.ru - Flowers P., Theopold K., & Langley R. (s.f.). Periodicity. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- The Open University. (2020). Chemical patterns are to be found in the periodic table: Chemical periodicity. Recuperado de: open.edu
