Ácidos y bases: diferencias, características, ejemplos
Los ácidos y las bases son compuestos químicos que no presentan una sola definición, sino varias, las cuales dependen de las características o propiedades que se toman en consideración. En términos generales, se pudiera decir que los ácidos son sustancias agrias, mientras que las bases son saponáceas o jabonosas.
Las definiciones más importantes, como la de Brönsted-Lowry, o la de Arrhenius, se centran más en la liberación de iones H3O+ (hidronio) u OH–(hidroxilo) por parte de estas sustancias. Ya sea en sus formas puras o disueltas en agua.
Una definición que surge como consecuencia de lo anterior es la siguiente: los ácidos disueltos en agua generan soluciones con valores de pH menores a 7, mientras que las bases disueltas producen soluciones con valores de pH mayores que 7. El pH es precisamente una forma de expresar qué tan ácido o básico es un líquido tomando en cuenta la concentración de H3O+.
Por lo tanto, las sustancias ácidas, como el jugo de naranja, tienen un pH menor a 7 y muchos iones H3O+. Mientras las bases, como el legía, poseen un pH mayor a 7 y muchos iones OH–.
Ácidos | Bases | |
Tipo de sustancia | Sustancias agrias. | Sustancias jabonosas. |
pH | pH menor a 7. | pH mayor a 7. |
Sabor | Agrio. | Amargo. |
Tinción | Tiñen de rojo el papel tornasol. | Tiñen de azul el papel tornasol. |
Características | Contienen y liberan hidrógenos. | Algunas presentan grupos OH. |
Corrosión | Son corrosivos. | No son corrosivas. |
Ejemplos | Ácido clorhídrico, ácido sulfúrico, ácido clórico. | Hidróxido de litio, amoníaco, hidróxido de sodio. |
Ácidos

Características de los ácidos
Las sustancias ácidas tienen ciertas características:
Sabor agrio
Los ácidos tienen un sabor agrio. En forma rutinaria, se designa con el término ‘ácido’ a un tipo de sabor. Así, se dice que el jugo limón y el líquido de algunos chicles son ácidos, ya que sus sabores son agrios y fuertes para el paladar.
Tiñen de rojo el papel tornasol
Los ácidos son sustancias capaces de virar el color del papel tornasol de azul a rojo. El tornasol forma parte de un conjunto de sustancias que pueden cambiar de color dependiendo del grado de acidez o basicidad del medio en que se encuentran. Estas sustancias son llamadas indicadores de pH.
Contienen y liberan hidrógenos
Los ácidos son compuestos químicos que poseen en su estructura el elemento químico hidrógeno (H), que le otorga su característica de acidez.
Muchas otras sustancias también contienen hidrógeno, pero no pueden liberarlo como sucede con los ácidos. Al liberarse, el hidrógeno está en la forma de ion o catión H+. Estos H+, al encontrarse con las moléculas de agua, se adicionan a estas para formar los iones H3O+.
Transportan la corriente eléctrica
Debido a los átomos de H+ que se liberan al disolverse los ácidos en el agua, estos son capaces de transportar la electricidad mediante el uso de pilas o baterías.
Son corrosivos
Existen ácidos fuertes que son muy corrosivos. Por lo tanto, debe evitarse el contacto con ellos, ya que pueden provocar daños físicos severos. Incluso los ácidos débiles, a muy altas concentraciones, como el acético (el del vinagre) pueden quemar la piel y la faringe si se respira sus vapores.
Fuertes y débiles
Los ácidos fuertes producen una gran concentración de iones H3O+ cuando se disuelven en el agua. Se dice que los átomos de hidrógeno de los ácidos fuertes son fácilmente disociables. Mientras, los ácidos débiles liberan pocos átomos de hidrógeno y, por ende, producen una menor concentración de iones H3O+.
Los ácidos fuertes presentan un pH muy bajo, que dependiendo de la concentración y la fuerza del ácido, puede ser de 1 o menos. En cambio, los ácidos débiles presentan un pH ácido más alto, el cual puede ser por ejemplo 4 o 5.
Los ácidos fuertes tienen un olor que produce una sensación quemante. Mientras, los ácidos débiles no presentan este tipo de olor, inclusive en algunos casos presentan olores agradables. No obstante, hay muchas excepciones, por lo que no se recomiendan andar oliendo ni siquiera ácidos débiles.
Los ácidos fuertes son buenos transportadores de la electricidad. Por lo contrario, los ácidos débiles son malos conductores de la electricidad al liberar pocos átomos de H+.
Los ácidos fuertes son capaces de atacar a metales, como por ejemplo, el cinc, formando gran cantidad de burbujas del gas hidrógeno. Esta reacción no es producida por los ácidos débiles.
Ejemplos de ácidos
Ácidos fuertes
-HCl: ácido clorhídrico
-H2SO4: ácido sulfúrico
-HBr: ácido bromhídrico
-HI: ácido yodhídrico
-HNO3: ácido nítrico
-HClO4: ácido perclórico
-HClO3: ácido clórico
Ácidos débiles
-CH3COOH: ácido acético
-HNO2: ácido nitroso
-H2CO3: ácido carbónico
-H3PO4: ácido fosfórico
-C3H5O(COOH): ácido cítrico
-HF: ácido fluorhídrico
-H2SO3: ácido sulfuroso
Bases
Características de las bases
Las bases presentan las siguientes características:
–Producen una sensación viscosa o jabonosa en los dedos, haciendo que los objetos asidos por las manos se tornen resbaladizos.
–Tienen un sabor amargo.
–Pueden reaccionar con los ácidos, produciendo la formación de compuestos llamados sales. En algunos casos, estas pueden precipitar o hundirse en el agua. Asimismo, en la reacción de una base con un ácido se forma agua.
–Tornan el color del papel tornasol en azul, indicando que la solución tiene un pH mayor de 7 o alcalino.
–Algunas bases presentan en su fórmula química grupos OH, llamados hidroxilos, los cuales están formados por un átomo de hidrógeno y un átomo de oxígeno.
Fuertes y débiles
Las bases fuertes son compuestos químicos que presentan en su estructura química uno o más grupos OH, los cuales cuando entran en contacto con el agua adquieren una carga negativa, OH–.
Mientras, las bases débiles no presentan en su fórmula química grupos hidroxilos. Sin embargo, las bases débiles al reaccionar con el agua producen también iones o aniones OH–.
Las bases fuertes, como el hidróxido de sodio, presentan valores de pH muy altos, cercanos a 14. Mientras, las bases débiles presentan pH más bajos, como por ejemplo el amoníaco, el cual tiene un pH de 11.
Las bases fuertes se usan en los hogares para destapar los desagües. Tal es caso del hidróxido de potasio. Mientras, las bases débiles se usan en labores de limpieza, como el amoníaco presente en muchos limpiadores.
Ejemplos de bases
Bases fuertes
-LiOH: hidróxido de litio
-NaOH: hidróxido de sodio
-KOH: hidróxido de potasio
-RbOH: hidróxido de rubidio
-CsOH: hidróxido de cesio
-Sr(OH)2: hidróxido de estroncio
-Ba(OH)2: hidróxido de bario
Bases débiles
-NH3: amoníaco
-NHEt2: dietilamina
-NH2CH3: metilamina
-C5H5N: piridina
Diferencias entre ácidos y bases
Iones que liberan
Los ácidos liberan átomos de H+ o H3O+ cuando se disuelven en el agua. Mientras, las bases liberan o producen en contacto con el agua iones OH–.
Valores de pH
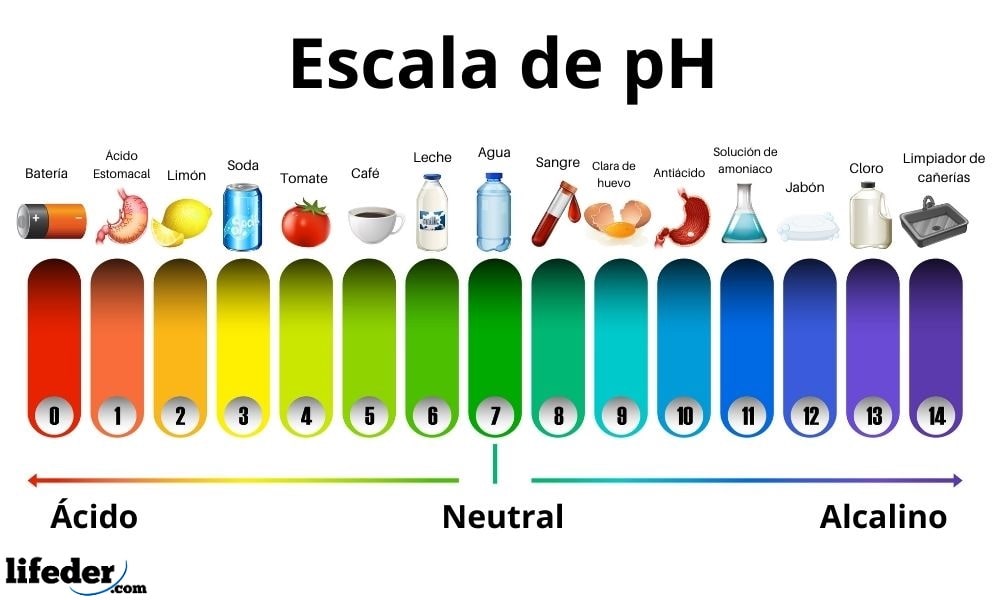
Los ácidos presentan un valor de pH comprendido entre 0 y 7. Mientras, las bases tienen un valor de pH entre 7 y 14. Por lo tanto, los ácidos tornan a rojo el color del papel tornasol y las bases lo viran en azul.
Reacciones de formación
Los ácidos se originan por la reacción de los óxidos de elementos no metálicos, por ejemplo cloro, azufre, etc., con el agua, o también se forman cuando el hidrógeno se combina con un elemento no metálico y luego el compuesto formado se disuelve en agua (HF, HCl, HBr, etc.).
Las bases se producen por la reacción del óxido de un metal, por ejemplo hierro, cobre, magnesio, etc., con el agua. Debe recordarse que un óxido es la combinación de átomos de oxígeno con cualquier otro elemento químico.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (11 de febrero de 2020). Acid Definition and Examples. Recuperado de: thoughtco.com
- Science Explorers. (31 de julio de 2018). Teaching Children About Acids and Bases. Recuperado de: scienceexplorers.com
- Redacción Ejemplode. (2013). Características de los ácidos. Recuperado de: ejemplode.com
- Lumen Chemistry for Non-Majors. (s.f.). Properties of Acids and Bases. Recuperado de: courses.lumenlearning.com
- Clark Jim. (2013). Strong and Weak Bases. Recuperado de: chemguide.co.uk
