Apoenzima: características, funciones y ejemplos
Las apoenzimas son las formas inactivas de las enzimas, es decir, son las enzimas que carecen de sus cofactores o coenzimas, que les son imprescindibles para llevar a cabo las reacciones catalíticas de las que están encargadas.
Las enzimas son proteínas con actividad catalítica. Su función es, básicamente, acelerar el curso de diferentes tipos de reacciones químicas en las células, hecho que reviste suma importancia para la existencia de todos los seres vivos sobre la tierra.
La actividad de muchas enzimas depende de la identidad y el ordenamiento de los aminoácidos que las conforman, es decir, de sus propias estructuras proteicas, y de la integridad de dichas estructuras en condiciones nativas.
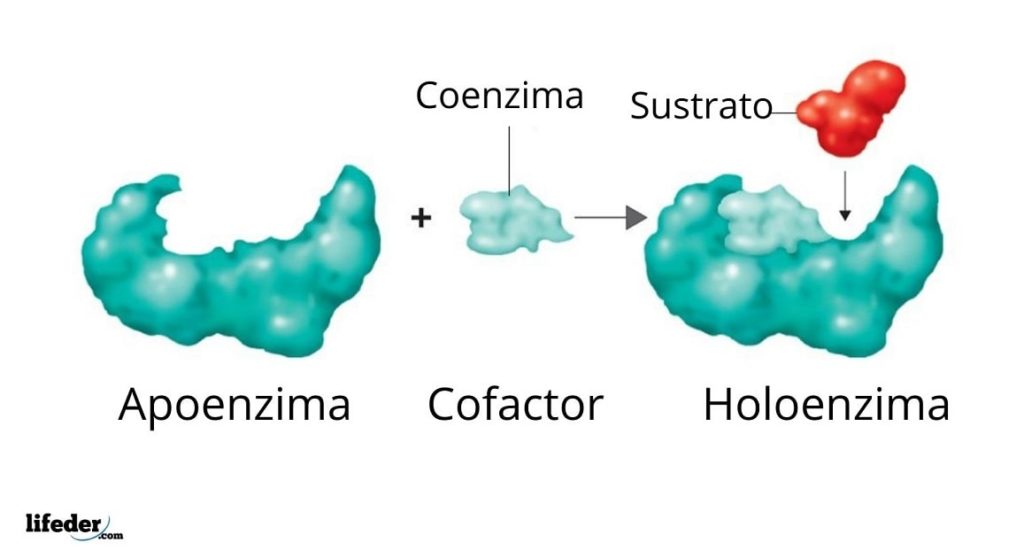
Si bien esto es cierto para muchas enzimas, existen unas que requieren elementos no proteicos adicionales para llevar a cabo sus funciones. A tales elementos se les conoce como cofactores, si se trata de iones inorgánicos, o coenzimas, si se trata de complejos o moléculas orgánicas.
Generalmente, tanto los cofactores como las coenzimas están asociados con relativa estabilidad a la estructura proteica de las enzimas cuya actividad catalítica promueven; cuando esta asociación es permanente (covalente), a dichos grupos se les conoce entonces como grupos prostéticos.
Ejemplos de apoenzimas
El conjunto enzimático activo formado por una proteína con actividad catalítica y su cofactor/coenzima/grupo prostético se denomina holoenzima o enzima conjugada. En una holoenzima, la porción proteica corresponde a lo que se conoce como apoenzima o apoproteína, que carece de actividad.
Ejemplos de algunas apoenzimas importantes son:
- La enzima ADN polimerasa, encargada de replicar el ADN celular, sin el ion divalente de magnesio que le sirve de cofactor.
- La enzima anhidrasa carbónica, encargada de catalizar la conversión de CO₂ y H₂0 en iones bicarbonato y H+, sin el ion divalente de zinc que le sirve de cofactor.
- La enzima hemoglobina, encargada de transportar oxígeno en el interior de los glóbulos rojos (eritrocitos) por la sangre de los animales mamíferos, sin su grupo prostético hemo.
- La enzima lactato deshidrogenasa, encargada de la producción de lactato a partir de piruvato, sin el NADH que le sirve de cofactor.
Características de las apoenzimas
Las apoenzimas son enzimas inactivas que necesitan, en aras de conseguir su activación, la unión de un cofactor o de una coenzima, pero que no están unidas a uno.
Teniendo esto en cuenta se puede decir que tales moléculas comparten ciertas características, a saber:
Son proteínas
A diferencia de los cofactores y las coenzimas, que son elementos no proteicos necesarios para las funciones de las holoenzimas, las apoenzimas son proteínas.
De la afirmación anterior se entiende, entonces, que las apoenzimas están formadas por cadenas de unas moléculas especiales conocidas como aminoácidos, los cuales están unidos entre sí a través de un tipo de enlace conocido como enlace peptídico.
La secuencia aminoacídica de cada apoenzima está determinada genéticamente y esta, a su vez, condiciona su ordenamiento espacial o tridimensional, íntimamente relacionado con la especificidad de sustratos, la unión a los cofactores/coenzimas/grupos prostéticos, establecimiento del sitio activo, etc.
Como proteínas, las apoenzimas tienen, además: una carga eléctrica, determinada por su contenido aminoacídico y el pH del medio donde se encuentran; requerimientos de temperatura, pH y fuerza iónica característicos en los que puede, en presencia de los cofactores, funcionar a su velocidad óptima; inhibidores y competidores, etc.
Pueden unirse a los sustratos
Aunque no son capaces, por sí solas, de catalizar una reacción enzimática, muchas apoenzimas conservan la capacidad de unirse a los sustratos que participan en la reacción que las caracteriza; por esta razón suelen ser empleadas en algunos contextos experimentales.
Pueden unirse a cofactores, coenzimas o grupos prostéticos
En la mayor parte de los casos, las apoenzimas pueden considerarse como enzimas inactivas que están preparadas para unirse a aquellas moléculas que asisten sus funciones, esto es: a sus cofactores, coenzimas o grupos prostéticos.
Los cofactores pueden participar directamente en las reacciones catalíticas o simplemente contribuir en la estabilización de la estructura general de la holoenzima.
Entre los principales cofactores que participan en las holoenzimas celulares están:
– Hierro (Fe2+)
– Cobre (Cu2+)
– Calcio (Ca2+)
– Zinc (Zn2+)
– Magnesio (Mg2)
– Manganeso (Mn2+)
– Cobalto (Co)
– Níquel (Ni)
Entre las principales coenzimas se pueden nombrar:
– Vitaminas: B9, B3, C
– Adenosín trifosfato (ATP)
– Flavín adenín dinucleótido (FAD)
– Dinucleótido de nicotinamida o nicotín adenín dinucleótido (NAD)
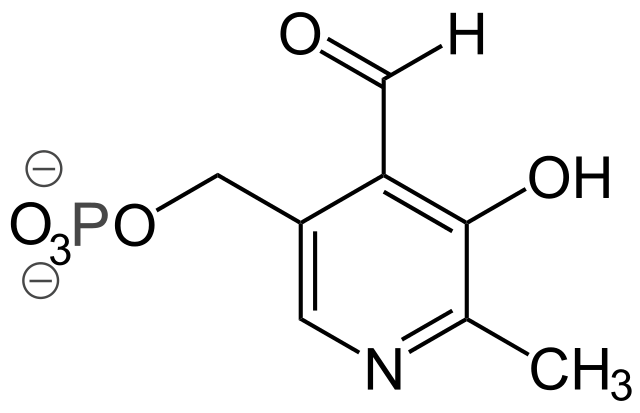
Algunos grupos prostéticos importantes son:
– Grupo hemo
– Biotina
– Pirofosfato de tiamina
– Piridoxal-fosfato
Funciones de las apoenzimas
Dado que las apoenzimas son las porciones proteicas de las holoenzimas, es justo considerarlas como su parte más importante. Incluso en presencia de los cofactores, coenzimas y sustratos adecuados, sin las apoenzimas no podría llevarse a cabo ninguna de las reacciones enzimáticas catalizadas por estas enzimas.
En este sentido, la principal función de una apoenzima es aportar tanto la estructura principal de la holoenzima a la que pertenece, como el sitio de unión para el cofactor, la coenzima y/o grupo prostético y el o los sustratos que participan en la reacción.
Desde el punto de vista estructural, una holoenzima sin su apoenzima no es más que un cofactor, y un cofactor por sí solo no es más que una molécula relativamente inerte (biológicamente hablando), de tal modo que la apoenzima es la encargada, en realidad, de llevar a cabo la reacción catalítica, asistida por los elementos no proteicos mencionados.
Así pues, las funciones de las apoenzimas, aunque se trate de enzimas inactivas, dependen de:
– Su cadena lineal de aminoácidos o estructura primaria (si son complejos enzimáticos formados por más de una subunidad, entonces se hablaría de “sus cadenas lineales”).
– La forma en la que estas cadenas se ordenan en el espacio, es decir las estructuras secundarias, terciarias y cuaternarias, cuando sea el caso.
– La conformación adecuada de los sitios que son fundamentales para la catálisis, es decir, el sitio catalítico con los aminoácidos que participan en la reacción, el o los sitios de unión para los cofactores, coenzimas o grupos prostéticos; etc.
– La estabilidad de la estructura en las condiciones celulares o nativas, hecho que está directamente relacionado con la capacidad de la apoenzima para formar la holoenzima, y otros.
Referencias
- Boyer, P. D., & Krebs, E. G. (1986). The enzymes. Academic Press.
- Garrett, R. H., & Grisham, C. M. (2001). Principles of biochemistry: with a human focus. Brooks/Cole Publishing Company.
- Gruber, K., Puffer, B., & Kräutler, B. (2011). Vitamin B 12-derivatives—enzyme cofactors and ligands of proteins and nucleic acids. Chemical Society Reviews, 40(8), 4346-4363.
- Murray, R. K., Granner, D. K., Mayes, P. A., & Rodwell, V. W. (2014). Harper’s illustrated biochemistry. Mcgraw-hill.
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Staiano, M., Pennacchio, A., Varriale, A., Capo, A., Majoli, A., Capacchione, C., & D’Auria, S. (2017). Enzymes as sensors. In Methods in enzymology (Vol. 589, pp. 115-131). Academic Press.
