Sincitiotrofoblasto: características, función, apoptosis placentaria
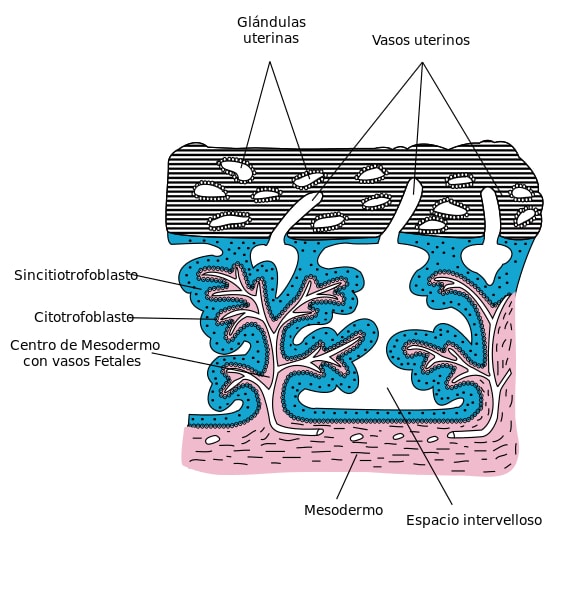
El sincitiotrofoblasto es una masa citoplasmática multinucleada que conforma la capa externa del trofoblasto y contacta con tejido materno. Esta capa celular se encuentra invadiendo al epitelio y estroma del endometrio durante el desarrollo embrionario de los mamíferos. Las células que componen al sincitiotrofoblasto se fusionan entre sí, perdiendo sus membranas celulares.
Esta capa de células se origina por diferenciación celular del citotrofoblasto y es la responsable del intercambio de gases y nutrientes entre la madre y el feto. Además, es capaz de producir hormonas y péptidos en la fase de implantación del blastocisto al endometrio y la formación de la placenta.
Índice del artículo
Como su nombre lo indica, las células del sincitiotrofoblasto han perdido sus membranas y se han fusionado, dándole a esta capa celular una apariencia multinucleada de tipo sincitial.
Estas células recubren de forma ininterrumpida la superficie vellositaria coriónica, la decidua basal y la placa coriónica y conforma parte de la barrera placentaria que se encarga de separar la sangre de la madre y la fetal.
El sincitiotrofoblasto se origina por la proliferación y fusión de las células del citotrofoblasto. Las células de esta capa no tienen capacidad proliferativa, es decir, no sufren mitosis, por lo que la expansión y mantenimiento de esta capa celular depende solamente de la incorporación continua de células desde el citotrofoblasto, asegurando su funcionalidad.
Estas células poseen complejos de Golgi y abundantes retículos endoplasmáticos lisos y rugosos, además presentan gran cantidad de mitocondrias e inclusiones lipídicas.
Esta capa de células dispone también una función secretora, liberando progesterona, estrógeno, gonadotropina coriónica humana (hCG) y lactógenos. Al envejecer el material celular, este es envuelto en una membrana protectora y desechado a través de la circulación materna.
El blastocito se une al endometrio iniciando una etapa de rápida proliferación celular, con la diferenciación del trofoblasto en citotrofoblasto y sincitiotrofoblasto. Este último se extiende por el epitelio del endometrio hasta llegar a su estroma, donde las células se llenan de lípidos y glucógeno convirtiéndose en células deciduales.
Estas células deciduales sufren procesos degenerativos que les permite proveer de nutrientes al embrión en desarrollo.
Una vez implantado el blastocisto al endometrio por el proceso de implantación o nidación, la fusión de las células más externas del trofoblasto, dan lugar al sincitiotrofoblasto primitivo.
Posteriormente se forman unas lagunas ocupadas por secreciones glandulares del endometrio que luego serán reemplazadas por la sangre materna, al debilitar los vasos capilares y las vénulas endometriales.
Estas lagunas intracelulares llenas de sangre materna definen la fase lacunar o trabecular y se van extendiendo hasta llegar al lado opuesto del punto de implantación.
Los espacios interlagunares en el sincitiotrofoblasto se denominan trabéculas. La embriogénesis que consiste en cambios en el embrioblasto del interior del blastocisto, también ocurre en esta etapa.
Una de las funciones fundamentales del sincitiotrofoblasto es el intercambio metabólico entre la madre y el feto, demostrando una alta actividad endocrina y participando en la homeostasis del desarrollo embrionario.
La aparición de lagunas intracelulares o trofoblásticas en el sincitiotrofoblasto da inicio al desarrollo de la circulación útero-placentaria. En estas lagunas desembocan los sinusoides derivados de los capilares de la porción materna de la placenta.
Un flujo direccional se forma por la presión diferencial entre los vasos circulatorios y las lagunas trofoblásticas. Este flujo va desde las arterias hasta las venas, formando la circulación útero-placentaria primitiva.
Existe una transferencia de nutrientes desde los vasos maternos hasta el embrión, que se hace evidentes al observar las abundantes vesículas pinocíticas del sincitiotrofoblasto.
La capa de células sincitiales recubre las vellosidades flotantes de la placenta. Estas vellosidades entran en contacto con la sangre materna al establecerse la circulación útero-placentaria, regulando así el transporte de oxígeno y nutrientes.
La apoptosis o muerte programada de las células resulta ser un componente importante en el desarrollo embrionario, ocurriendo de esta forma la eliminación de células seleccionadas, para prevenir la pérdida indiscriminada de células. La fusión sincitial de las células del citotrofoblasto es la fase inicial de la cascada apoptótica.
En la etapa inicial de la apoptosis las células del citotrofoblasto proliferan y se fusionan para formar la capa sincitial o sincitiotrofoblasto.
En la fase de ejecución de la apoptosis, el material citoplasmático y nucleico del citotrofoblasto ha pasado a la capa sincitial, por lo que las células de esta última capa quedan equipadas con el material necesario para que se inicie la cascada apoptótica.
El proceso apoptótico presenta una pausa temporal debido a la acción de enzimas antiapoptóticas, sin embargo, la enzima caspasa 3 reactiva este proceso, pues activa a su vez componentes que degradan proteínas y ácidos nucleicos en las células. Otras enzimas encargadas de degradar los microfilamentos celulares son activadas.
Luego de la degradación de los componentes celulares, los desechos son empaquetados en membranas apicales del sincitiotrofoblasto, originando los nodos sincitiales o apoptóticos, que serán liberados finalmente en el torrente sanguíneo de la madre.
La preeclampsia es una patología presentada durante el embarazo. Algunas investigaciones han demostrado que esta patología es causada por una alteración en la diferenciación del trofoblasto debido a un exceso de procesos apoptóticos a este nivel.
La liberación de desechos apoptóticos en el torrente sanguíneo materno no provoca respuestas inflamatorias en la madre debido a que dichos desechos van protegidos por una membrana que evita que entren en contacto con estructuras maternas. El proceso de recubrimiento de los desechos toma algunas semanas.
En la preeclampsia se presenta un exceso de proliferación y fusión de las células citotrofoblásticas, lo que provoca un aumento de degradación celular en el sincitiotrofoblasto. Este aumento provoca una acumulación de desechos celulares, y un retraso en la formación de la membrana protectora de los mismos.
Esto provoca que desechos y microfragmentos parcialmente degradados, incluyendo enzimas del sincitiotrofoblasto pasen al torrente sanguíneo de la madre ocasionando daño tisular. Además de la preeclampsia, los estados de hipoxia en la placenta se han relacionado con un aumento en la apoptosis celular.
En las pacientes con preeclampsia se han hallado importantes concentraciones citoplasmáticas de microfragmentos del sincitiotrofoblasto. Estos microfragmentos pueden alterar el comportamiento de los macrófagos, provocando a la vez un aumento en la activación de los neutrófilos y disminución de la relajación endotelial.
Estas alteraciones en las células sanguíneas maternas explican los daños sistémicos y la manifestación de la preeclampsia, que provoca daño epitelial y una respuesta inflamatoria. Además de ocasionar daños en la placenta por un aumento en los depósitos de fibrinoide sobre las vellosidades.
- Flores, A. M., Montoya, J. B., Aguilar, A. O., & Ortega, F. V. (2006). Development and validation of an in vitro culture model for the study of the differentiation of human trophoblast. Ginecologia y obstetricia de Mexico, 74(12), 657-665.
- Hernández-Valencial, M., Valencia-Ortega, J., Ríos-Castillo, B., Cruz-Cruz, P. D. R., & Vélez-Sánchez, D. (2014). Elements of implantation and placentation: clinical and melecular aspects. Revista Mexicana de Medicina de la Reproducción, 6(2), 102-116.
- Reece, E. A., & Hobbins, J. C. (2010). Obstetricia Clinica/Clinical Obstetrics. Ed. Médica Panamericana.
- Rodríguez, M., Couve, C., Egaña, G., & Chamy, V. (2011). Apoptosis placentaria: mecanismos moleculares en la génesis de la preclampsia. Revista chilena de obstetricia y ginecología, 76(6), 431-438.
- Ross, M. H., & Pawlina, W. (2007). Histología. Ed. Médica Panamericana.
- Roura, L. C. (2007). Obstetricia y medicina materno-fetal. Ed. Médica Panamericana.
