Fibrina: estructura y funciones
La fibrina es una proteína con forma de hilo, presente en la sangre en su forma precursora, el fibrinógeno, que puede polimerizar fácilmente formando filamentos de fibrina. Estos filamentos forman una red de malla fina capaz de retener las células sanguíneas durante la formación de un coágulo.
El fibrinógeno forma parte de las denominadas proteínas plasmáticas, junto con la albúmina y las globulinas. Es una proteína fibrosa que se transforma en fibrina en presencia de la enzima trombina.
Actualmente la fibrina es empleada en la medicina regenerativa, junto con otros elementos proteicos sanguíneos, como el factor de crecimiento, para promover la regeneración tisular.
Índice del artículo
- 1 Estructura
- 2 Funciones
- 3 Patologías relacionadas con la fibrina
- 4 Aplicaciones de la fibrina
- 5 Referencias
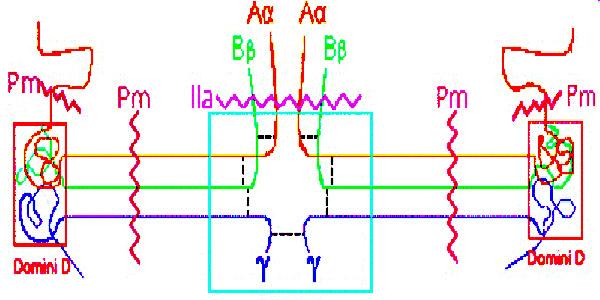
En la composición del fibrinógeno, intervienen tres dominios globulares, dos D, en los extremos, y uno E, en el centro. Básicamente, está formado por tres cadenas de polipéptidos, con una longitud total de 46 nm y que se enrrollan formando una hélice alfa.
Por acción de la enzima trombina, el fibrinógeno pierde los fibrinopéotidos A y B, los cuales son terminales, y responsables de repeler otras moléculas de fibrinógeno. Se forma así un monómero de fibrina.
Los monómeros de fibrina polimerizan formando un polímero denominado filamento de fibrina. Este filamento se estabiliza gracias a la acción de un factor denominado FXIIIa, formando un polímero insoluble.
La función de la fibrina es actuar como un aglutinante encargado de formar una malla alrededor del tapón plaquetario, conformando un coágulo de fibrina.
También se encarga de mantener la costra adherida a la lesión hasta la formación del nuevo tejido epitelial.
En la formación del coágulo sanguíneo intervienen numerosas sustancias que interactúan en una forma compleja y secuencial denominada cascada de coagulación. Una explicación simplificada de este proceso es la siguiente:
En la sangre circula libremente un complejo inactivo formado por dos sustancias combinadas: la protrombina y la antiprotrombina. Cuando ocurre alguna lesión, las células tisulares dañadas y las plaquetas en contacto con la lesión liberan una sustancia llamada tromboplastina.
La tromboplastina desplaza a la protrombina de la unión que forman con la antiprotrombina, quedando de esa manera libre la protrombina. Esta, en presencia de iones de calcio de la sangre, se transforma en una molécula más activa llamada trombina.
La trombina actúa como catalizador orgánico sobre una de las proteínas plasmáticas soluble, el fibrinógeno. Este se transforma en fibrina, que es insoluble, polimeriza formando largos filamentos y luego precipita. Los filamentos de fibrina forman una red o malla que atrapa plaquetas y células sanguíneas bloqueando parcialmente la pérdida de sangre.
Las plaquetas atrapadas en la red de fibrina se unen a esta y en corto tiempo comienzan a contraerse. Debido a ello el coágulo también se contrae, liberándose los líquidos sobrantes dentro de la red de fibrina; este es el exudado que se observa en las heridas en cicatrización.
Cuando el coágulo se contrae los bordes de la herida tienden a unirse. Cuando el coágulo está en contacto con el aire, este ocasiona que el coágulo se seque y se forme lo que se conoce como costra. El fibrinógeno mantendrá esta costra unida a la herida mientras dure la cicatrización.
Una hipótesis más reciente de la formación del coágulo sanguíneo, recibe el nombre de modelo celular de coagulación. Según este modelo, el proceso se realiza en tres fases, una de iniciación, otra de amplificación y una de propagación.
Si bien es cierto que la fibrina es indispensable para hemostasis, una producción excesiva o deficiente de esta molécula puede ocasionar efectos adversos en el organismo. La producción excesiva de fibrina puede ocasionar trombosis. En el otro extremo, una producción deficiente de fibrina puede conllevar a la aparición de hemorragias.
El fibrinógeno, precursor de la fibrina, se encuentra en concentraciones normales de 200-400 mg/dl; en las mujeres, la concentración es ligeramente mayor que en los hombres. La insuficiencia renal y/o hepática y otros daños hepáticos, así como algunas infecciones pueden elevar las concentraciones de fibrinógeno en la sangre.
Las concentraciones de esta proteína plasmática también pueden elevarse por enfermedades como el lupus eritematoso, la lepra, la leucemia, diabetes, o por factores como obesidad, tabaquismo, estrés, entre otros.
En cambio, niveles muy bajos de fibrinógeno ocasionan, como ya se señaló, la propensión a hemorragias, y pueden deberse también a múltiples factores, entre ellos infecciones bacterianas, quemaduras y cáncer.
La afibrinogenia es una enfermedad que puede ser congénita o adquirida, se caracteriza por la ausencia o muy baja concentración de fibrinógeno en la sangre. Debido a ello, quien la padece es incapaz de formar coágulos sanguíneos en heridas.
También puede deberse a liberación inadecuada de tromboplastina en el torrente sanguíneo, ocasionando que el fibrinógeno se transforme en fibrina sin formar trombos, disminuyendo la disponibilidad de fibrinógeno en la sangre.
La disfibrinogenia, por su parte, es otra enfermedad ocasionada, en este caso, por un mal funcionamiento del fibrinógeno. Es una enfermedad genética y quienes la padecen pueden no manifestar evidencia clínica o pueden presentar tendencia a sangrar, y/o a padecer trombosis.
Otras enfermedades relacionadas con la fibrina, o con el fibrinógeno, son la hipofibrinogenemia, concentraciones bajas de fibrinógeno en la sangre, y la hipodisfibrinogenemia, concentraciones bajas y disfuncionales del fibrinógeno.
La medicina regenerativa es una rama de la medicina alternativa que emplea métodos novedosos para tratar diferentes tipos de lesiones difíciles de tratar con la medicina tradicional. Los elementos proteicos sanguíneos o hemoderivados, han permitido prometedores avances en este tipo de tratamientos.
Uno de estos hemoderivados es, precisamente, la fibrina. Esta sustancia es empleada en forma de parches de fibrina para la reparación de lesiones en la piel. Generalmente se emplea con plasma rico en plaquetas (PRP).
Estas sustancias son extraídas de sangre autóloga (proveniente del mismo paciente), lo cual disminuye riesgos de transmisión de enfermedades como hepatitis o VIH.
Una de las primeras áreas en aplicar este tipo de terapia es la odontología, donde estos tratamientos han mostrado su capacidad para potenciar la disminución del edema, y del dolor postoperatorio, así como para disminuir el tiempo requerido para la curación.
También han sido empleados con resultados alentadores o exitosos en casos de osteonecrosis de maxilares y mandibulares y de ritidectomía. Actualmente se realizan pruebas en otras áreas como otorrinolaringología, medicina del deporte, ortopedia y oftalmología, entre otras.
En veterinaria han sido empleados exitosamente para fracturas y heridas cutáneas en caballos de carrera.
- I. Hernández, G. Rossani & R. Castro-Sierra (2015). Beneficios del adhesivo autólogo de fibrina y PRP en ritidectomía. Cirugía Plástica Iberolatinoamericana.
- Q.M. Zhao, Y.J. Ding & T. Si (2013). Platelet-rich fibrin in plastic surgery. Medicine.
- C.P. Hickman, L.S. Roberts, A. Larson, H. L’Anson & D.J. Eisenhour (2006). Integrates principles of Zoology. 6th edition. McGraw-Hill.
- Fibrin. En Wikipedia. Recuperado de en.wikipedia.org.
- Fibrinogen. En Wikipedia. Recuperado de en.wikipedia.org.
- B. Guerrero & M. López (2015). Generalidades del sistema de la coagulación y pruebas para su estudio. Investigación Clínica.
