Glucólisis aeróbica: reacciones e intermediarios glucolíticos
La glucólisis aeróbica o aerobia se define como el uso del exceso de glucosa que no es procesado por fosforilación oxidativa hacia la formación de productos “fermentativos”, aún en condiciones de altas concentraciones de oxígeno y a pesar de la caída en el rendimiento energético.
Se da comúnmente en tejidos con altas tasas proliferativas, cuyo consumo de glucosa y oxígeno es elevado. Ejemplo de ello son células tumorales cancerosas, algunas células parasitarias de la sangre de mamíferos e incluso las células de algunas zonas del cerebro de los mamíferos.
La energía extraída por el catabolismo de la glucosa se conserva en forma de ATP y NADH, que son empleados aguas abajo en diversas vías metabólicas.
Durante la glucólisis aeróbica el piruvato es dirigido hacia el ciclo de Krebs y la cadena transportadora de electrones, pero también se procesa por la vía fermentativa para la regeneración de NAD+ sin producción adicional de ATP, que finaliza con la formación de lactato.
La glucólisis aeróbica o anaeróbica ocurre principalmente en el citosol, con la excepción de organismos como los tripanosomátidos, que poseen organelas glucolíticas especializadas conocidas como glicosomas.
La glucólisis es una de las vías metabólicas mejor conocida. Fue formulada por completo en la década de 1930 por Gustav Embden y Otto Meyerhof, que estudiaron la ruta en las células de músculo esquelético. No obstante, la glucólisis aeróbica se conoce como el efecto Warburg desde 1924.
Índice del artículo
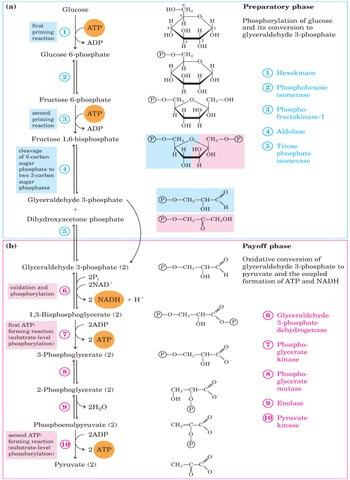
El catabolismo aeróbico de la glucosa ocurre en diez pasos catalizados enzimáticamente. Muchos autores consideran que estos pasos están divididos en una fase de inversión energética, que tiene como finalidad aumentar el contenido de energía libre en los intermediarios, y otra de reposición y la ganancia de energía en forma de ATP.
1-Fosforilación de la glucosa a glucosa 6-fosfato catalizada por la hexoquinasa (HK). En esta reacción se invierte, por cada molécula de glucosa, una molécula de ATP, que actúa como donador de grupo fosfato. Rinde glucosa 6-fosfato (G6P) y ADP, y la reacción es irreversible.
La enzima requiere obligatoriamente de la formación de un completo Mg-ATP2- para su funcionamiento, por lo que amerita iones magnesio.
2-Isomerización de la G6P a fructosa 6-fosfato (F6P). No involucra gasto energético y es una reacción reversible catalizada por la fosfoglucosa isomerasa (PGI).
3-Fosforilación de la F6P a fructosa 1,6-bifosfato catalizada por la fosfofructoquinasa-1 (PFK-1). Se emplea una molécula de ATP como donador de grupo fosfato y los productos de la reacción son F1,6-BP y ADP. Gracias a su valor de ∆G, esta reacción es irreversible (tal y como la reacción 1).
4-Ruptura catalítica de la F1,6-BP en dihidroxiacetona fosfato (DHAP), una cetosa, y gliceraldehído 3-fosfato (GAP), una aldosa. La enzima aldolasa es la responsable de esta condensación aldólica reversible.
5-La triosa-fosfato isomerasa (TIM) se encarga de la interconversión de las triosas fosfato:DHAP y el GAP, sin aporte de energía adicional.
1-El GAP es oxidado por el gliceraldehído 3-fosfato deshidrogenasa (GAPDH), que cataliza la transferencia de un grupo fosfato al GAP para formar 1,3-bifosfoglicerato. En esta reacción se reducen dos moléculas de NAD+ por molécula de glucosa, y se utilizan dos moléculas de fosfato inorgánico.
Cada NADH producido pasa por la cadena transportadora de electrones y se sintetizan 6 moléculas de ATP por fosforilación oxidativa.
2-La fosfoglicerato quinasa (PGK) transfiere un grupo fosforilo desde el 1,3-bifosfoglicerato hasta el ADP, formando dos moléculas de ATP y dos de 3-fosfoglicerato (3PG). Este proceso se conoce como fosforilación a nivel de sustrato.
Las dos moléculas de ATP consumidas en las reacciones de la HK y la PFK son repuestas por la PGK en este paso de la ruta.
3-El 3PG es convertido en 2PG por la fosfoglicerato mutasa (PGM), que cataliza el desplazamiento del grupo fosforilo entre el carbono 3 y 2 del glicerato en dos pasos y de forma reversible. El ion magnesio también es requerido por esta enzima.
4-Una reacción de deshidratación catalizada por la enolasa convierte el 2PG en fosfoenolpiruvato (PEP) en una reacción que no requiere de inversión energética, pero que genera un compuesto con mayor potencial energético para la transferencia del grupo fosfato posteriormente.
5-Finalmente, la piruvato quinasa (PYK) cataliza la transferencia del grupo fosforilo en el PEP a una molécula de ADP, con la producción concomitante de piruvato. Se emplean por molécula de glucosa dos moléculas de ADP y se generan 2 moléculas de ATP. La PYK emplea iones potasio y magnesio.
Así, el rendimiento energético total de la glucólisis es de 2 moléculas de ATP por cada molécula de glucosa que ingresa a la ruta. En condiciones aeróbicas la degradación completa de la glucosa implica la obtención de entre 30 y 32 moléculas de ATP.
Después la glucólisis, el piruvato es sometido a una descarboxilación, produciendo CO2 y donando el grupo acetilo a la acetil coenzima A, que también es oxidada hasta CO2 en el ciclo de Krebs.
Los electrones liberados durante esta oxidación son transportados hacia el oxígeno a través de las reacciones de la cadena respiratoria mitocondrial, que finalmente impulsa la síntesis de ATP en esta organela.
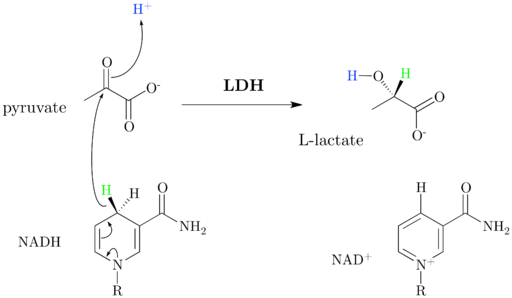
Durante la glucólisis aeróbica, el exceso de piruvato producido es procesado por la enzima lactato deshidrogenasa, que forma lactato y regenera parte del NAD+ consumido pasos arriba en la glucólisis, pero sin la formación de nuevas moléculas de ATP.
Además, el piruvato puede ser empleado en procesos anabólicos que conducen a la formación del aminoácido alanina, por ejemplo, o también puede actuar como esqueleto para la síntesis de ácidos grasos.
Al igual que el piruvato, el producto final de la glucólisis, muchos de los intermediarios de reacción cumplen otras funciones en rutas catabólicas o anabólicas importantes para la célula.
Tal es el caso de la glucosa 6-fosfato y la ruta de las pentosas fosfato, donde se obtienen los intermediarios de las ribosas presentes en los ácidos nucleicos.
- Akram, M. (2013). Mini-review on Glycolysis and Cancer. J. Canc. Educ., 28, 454–457.
- Esen, E., & Long, F. (2014). Aerobic Glycolysis in Osteoblasts. Curr Osteoporos Rep, 12, 433–438.
- Haanstra, J. R., González-Marcano, E. B., Gualdrón-López, M., & Michels, P. A. M. (2016). Biogenesis, maintenance and dynamics of glycosomes in trypanosomatid parasites. Biochimica et Biophysica Acta – Molecular Cell Research, 1863(5), 1038–1048.
- Jones, W., & Bianchi, K. (2015). Aerobic glycolysis: beyond proliferation. Frontiers in Immunology, 6, 1–5.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hypothesis: structures, evolution, and ancestor of glucose kinases in the hexokinase family. Journal of Bioscience and Bioengineering, 99(4), 320–330.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
