Cloruro de cromo (CrCl3): estructura, propiedades, usos
El cloruro de cromo (CrCl3) es una sal inorgánica compuesta por cationes Cr3+ y aniones Cl– en una proporción 1:3; es decir, que por cada Cr3+ hay tres Cl–. Como se verá más adelante, sus interacciones no son iónicas. Esta sal puede presentarse bajo dos formas: anhidra y hexahidratada.
La forma anhidra se caracteriza por presentar una coloración violeta-rojiza; mientras que la hexahidratada, CrCl3.6H2O, es de color verde oscuro. La incorporación de las moléculas de agua modifica las propiedades físicas de dichos cristales; como sus puntos de ebullición y fusión, las densidades, etc.

El cloruro de cromo (III) (de acuerdo a la nomenclatura stock) se descompone a altas temperaturas, transformándose en cloruro de cromo (II), CrCl2. Es corrosivo para los metales, aunque se usa en el cromado: procedimiento en que se recubren los metales con una capa delgada de cromo.
El Cr3+, proveniente de su respectivo cloruro, ha sido usado en el tratamiento de la diabetes, especialmente en los pacientes con una nutrición parenteral total (TPN), que no ingieren la cantidad de cromo requerida. Sin embargo, los resultados son mucho mejores (y más confiables) si se suministra como picolinato.
Índice del artículo
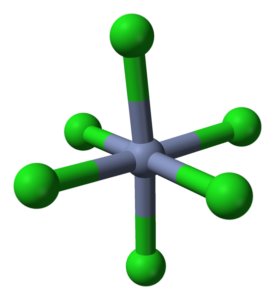
El CrCl3 pese a ser una sal, la naturaleza de sus interacciones no son puramente iónicas; tienen cierto carácter covalente, producto de las coordinaciones entre Cr3+ y Cl–, las cuales dan lugar a un octaedro deformado (imagen superior). El cromo se ubica en el centro del octaedro, y los cloros en sus vértices.
El octaedro CrCl6 puede, a primera vista, contradecir la fórmula CrCl3; sin embargo, este octaedro completo no define la celda unitaria del cristal, sino un cubo (deformado también), que corta a las esferas verdes o aniones de cloro por la mitad.
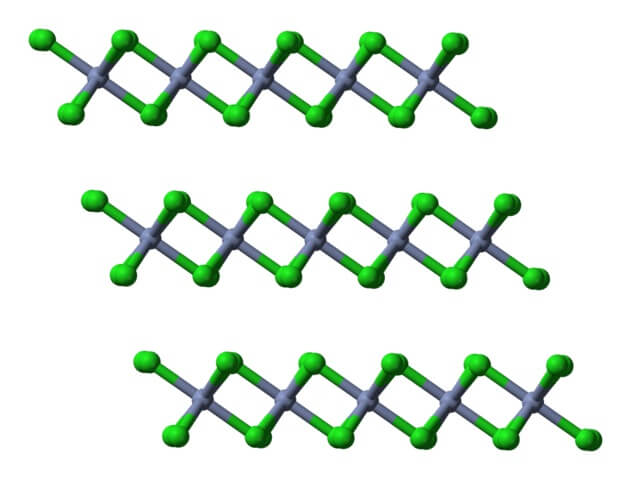
Así, la celda unitaria con este octaedro sigue mantiene la proporción 1:3. Reproduciendo dichos cubos deformados en el espacio, se obtiene el cristal de CrCl3, el cual se representa en la imagen superior con un modelo de llenado tridimensional, y un modelo de esferas y barras.

Esta capa cristalina es una de las muchas que conforman los cristales violeta-rojizos y escamosos del CrCl3 (no confundir el color del cristal, verdadero, con el de las esferas verdes).
Como se aprecia, los aniones Cl– ocupan la superficie, por lo que sus cargas negativas repelen a las otras capas cristalinas. Consecuentemente, los cristales se tornan escamosos y frágiles; pero brillante, a causa del cromo.
Si estas mismas capas son visualizadas desde una perspectiva lateral, se observará, en lugar de octaedros, tetraedros distorsionados:
Aquí se facilita aún más la comprensión de por qué las capas se repelen unas con otras cuando se unen los aniones Cl– de sus superficies.
-Cloruro de cromo (III)
-Tricloruro de cromo (III)
-Cloruro de cromo (III) anhidro.
-CrCl3 (anhidro).
-CrCl3.6H2O (hexahidratado).
-158,36 g/mol (anhidro).
-266,43 g/mol (hexahidrato).
-Sólidos y cristales de color violeta-rojizos (anhidro).
-Polvo cristalino verde oscuro (hexahidrato, imagen inferior). En este hidrato puede verse como el agua inhibe el brillo, característica metálica del cromo.

-1.152 ºC (2.106 ºF, 1.425 K) (anhidro)
-83 ºC (hexahidrato).
1300 ºC (2.370 ºF, 1.570) (anhidro).

-Ligeramente soluble (anhidro).
-585 g/L (hexahidrato).
En la imagen superior se muestra una serie de tubos de ensayo llenados con una disolución acuosa de CrCl3. Nótese que mientras más concentrada sea, más intenso es el color del complejo [Cr(OH2)6]3+, responsable del color verde.
Soluble en etanol, pero insoluble en éter (anhidro).
-2,87 gr/cm3 (anhidro).
-2,76 g/cm3 (hexahidrato).
30 ºC.
Cuando se calienta a descomposición, el cloruro de cromo (III) emite humos tóxicos de compuestos que contienen cloro. Estos compuestos también son liberados cuando el cloruro de cromo (III) entra en contacto con ácidos fuertes.
Es altamente corrosivo y puede atacar a ciertos aceros.
Es incompatible con los oxidantes fuertes. Asimismo, reacciona fuertemente con el litio y el nitrógeno.
Cuando se calienta en presencia de hidrógeno, se reduce a cloruro de cromo (II), con la formación de cloruro de hidrógeno.
2 CrCl3 + H2 => 2 CrCl2 + 2 HCl
En una solución acuosa, y con una concentración de 0,2 M: 2,4.
Se produce cloruro de cromo (III) hexahidrato, haciendo reaccionar el hidróxido de cromo con ácido clorhídrico y agua.
Cr(OH)3 + 3 HCl + 3 H2O => CrCl3.6H2O
Luego, para obtener la sal anhidra, se procede a calentar el CrCl3.6H2O en presencia de cloruro de tionilo, SOCl2, ácido clorhídrico, y calor:
[Cr(H2O)6]Cl3 + 6SOCl2 + ∆ → CrCl3 + 12 HCl + 6SO2
Alternativamente, el CrCl3 se obtiene pasando gas cloro sobre una mezcla de óxido de cromo y carbono.
Cr2O3 + 3 C + Cl2 => 2 CrCl3 + 3 CO
Y por último, siendo el método más utilizado, es calentar su óxido con un agente halogenante, como el tetracloruro de carbono:
Cr2O3 + 3CCl4 + ∆ → 2CrCl3 + 3COCl2
El cloruro de cromo interviene en la preparación in situ de cloruro de cromo (II); reactivo que interviene en la reducción de haluros de alquilo, y en la síntesis de haluros de (E)-alquenilo.
-Se utiliza en la técnica del cromado. Esta consiste en depositar, mediante la galvanoplastia, una capa fina de cromo sobre objetos de metal u otro material con un objetivo decorativo, aumentando así la resistencia a la corrosión y también la dureza superficial.
-Se utiliza como mordiente textil, sirviendo de enlace entre el material de tinción y las telas a ser teñidas. Además, se usa como catalizador para la producción de olefinas y agentes impermeabilizantes.
El uso de suplemento de cloruro de cromo USP, es recomendable en los pacientes que solo reciben soluciones intravenosas, administradas para la nutrición parenteral total (TPN). Por lo tanto, solo cuando estos pacientes no reciben todos sus requerimientos nutricionales.
El cromo (III) es parte del factor de tolerancia a la glucosa, un activador de las reacciones que promueve la insulina. Se piensa que el cromo (III) activa el metabolismo de la glucosa, las proteínas y los lípidos, facilitando la acción de la insulina en humanos y animales.
El cromo está presente en numerosos alimentos. Pero su concentración no excede a los 2 por ración, siendo el brócoli el alimento con mayor aporte (11 µg). Adicionalmente, la absorción intestinal del cromo es baja, con un valor de 0,4 a 2,5% de la cantidad ingerida.
Esto dificulta el establecimiento de una dieta para el suministro de cromo. En 1989, The National Academy of Sciences recomendó entre 50 a 200 µg/día como un ingesta adecuada de cromo.
Entre los posibles riesgos de los consumos de esta sal como suplemento de cromo están:
-Dolores estomacales fuertes.
-Sangrado anormal, que puede variar desde dificultades para que cicatrice una herida, moretones más rojos, o un oscurecimiento de las heces fecales producto del sangrado interno.
-Irritaciones en el sistema digestivo, ocasionando úlceras en el estómago o intestinos.
-Dermatitis
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Chromium(III) chloride. Recuperado de: en.wikipedia.org
- Chromium(III) Chloride [PDF]. Recuperado de: alpha.chem.umb.edu
- PubChem. (2019). Chromium chloride hexahydrate. Recuperado de: pubchem.ncbi.nlm.nih.gov
- National Institutes of Health. (21 de septiembre de 2018). Chromium: Dietary Supplement Fact Sheet. Recuperado de: ods.od.nih.gov
- Tomlinson Carole A. (2019). Chromium Chloride Side Effects. Leaf Group Ltd. Recuperado de: healthfully.com
